��Ŀ����
����Ŀ����������Դ�ǽ��������Ⱦ����Ҫ�ٴ룬���м״������������ʵ����ȼ�ϣ�������ȼ�ϵ�أ� 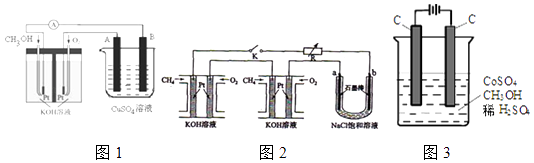
��1����֪��
��2CH3OH��l��+3O2��g��=2CO2��g��+4H2O��g����H1=��1274.0kJ/mol
��2CO��g��+O2��g��=2CO2��g����H2=��566.0kJ/mol ��H2O��g��=H2O��l����H3=��44kJ/mol�� �״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽΪ�� ��
��2�������ü״�ȼ�շ�Ӧ���һ��ȼ�ϵ�أ���ͼ1����Pt���缫���ϣ�������������Һ���������Һ���������缫�Ϸֱ����״���������
��д��ȼ�ϵ�ظ����ĵ缫��Ӧʽ ��
�������ø�ȼ�ϵ���ṩ��Դ����ͼ2�ұ��ձ������������������ͭ��������Ӧ�������A����B����������������������6.4gʱ��ȼ�ϵ�������������ı�״�������ΪL��
��3��ij�о�С�齫��������ȼ�ϵ�ش�������Ϊ��Դ�����б����Ȼ�����Һ���ʵ����ÿ����ؼ���ͨ����Ϊ1L����״�������ҷ�Ӧ��ȫ����������ͨ�����صĵ���Ϊ�������ڳ���F=9.65��l04C/mol��������ܲ������������ΪL����״������
��4����ⷨ�������״���ˮ����ɵ���Ⱦ��ԭ���ǣ�ͨ�罫Co2+������Co3+ �� Ȼ�״�������CO2��H+����ʯīϩ��ȥCo2+��������ͼ3��ʾװ��ģ���������̣���Co2+�������ĵ缫��ӦʽΪ
��ȥ�״������ӷ���ʽΪ ��
���𰸡�
��1��CH3OH��l��+O2��g��=CO��g��+2H2O��l����H1=��442.0kJ/mol
��2��CH3OH��6e��+8OH��=CO32��+6H2O��B��1.12
��3��3.45��104C��4
��4��Co2+��e��=Co3+����6Co2+��6e��=6Co3+����6Co3++CH3OH+H2O=6Co2++CO2��+6H+
���������⣺��1����֪����2CH3OH��l��+3O2��g���T2CO2��g��+4H2O��g����H1=��1274.0kJ/mol��2CO��g��+O2��g���T2CO2��g����H2=��566.0kJ/mol
��H2O��g���TH2O��l����H3=��44kJ/mol��
���ݸ�˹���ɼ��㣨�٩���+�ۡ�4���� ![]() �õ��״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽΪ��CH3OH��l��+O2��g��=CO��g��+2H2O��l����H=��442KJ/mol��
�õ��״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽΪ��CH3OH��l��+O2��g��=CO��g��+2H2O��l����H=��442KJ/mol��
���Դ��ǣ�CH3OH��l��+O2��g��=CO��g��+2H2O��l����H=��442KJ/mol����2����ȼ�ϵ�ظ�������ȼ��ʧ���ӵ�������Ӧ��������Ӧ�ĵ缫��ӦʽΪ��CH3OH��6e��+8OH��=CO32��+6H2O�����Դ��ǣ�CH3OH��6e��+8OH��=CO32��+6H2O�� �����ø�ȼ�ϵ���ṩ��Դ����ͼ1�ұ��ձ������������������ͭ�������������ص��������������Դ�������ӣ�װ��ͼ����״�������B�缫������������������������6.4gʱ��Cu2++2e��=Cu������ת��0.2mol��ȼ�ϵ�������������ĵ缫��ӦΪ��O2+2H2O+4e��=4OH�� �� ���ݵ����غ���������������ʵ���0.05mol����״�������=0.05mol��22.4L/mol=1.12L��
���Դ��ǣ�B��1.12����3�����ݵ�ʧ�����غ㣬�ɵã�1 mol CH4��8 mol e����4 mol Cl2 �� ����ÿ����ؼ���ͨ����Ϊ1 L����״����������4L Cl2������ͨ���ĵ���Ϊ ![]() ��8��9.65��l04Cmol��1=3.45��104C��������Ȼ������ȼ�ϵ�أ������ӵĴ�����ֻ����һ���صļ��������㣩
��8��9.65��l04Cmol��1=3.45��104C��������Ȼ������ȼ�ϵ�أ������ӵĴ�����ֻ����һ���صļ��������㣩
���Դ��ǣ�3.45��104C��4����4����ͨ���Co2+������Co3+ �� ����������ʧ���ӷ���������Ӧ���缫��ӦΪCo2+��e��=Co3+�����Դ��ǣ�Co2+��e��=Co3+��
����Co3+����������ˮ�еļ״�������CO2����������������ԭΪCo2+ �� ���ԭ���غ������غ��֪����ԭ����H+ �� ��ƽ��д���ӷ���ʽΪ��6Co3++CH3OH+H2O=CO2��+6Co2++6H+ �� ���Դ��ǣ�6Co3++CH3OH+H2O=CO2��+6Co2++6H+ ��

����Ŀ��һ����Na2O2��NaHCO3�����Ϻ����ܱ������м��ȳ�ַ�Ӧ���ų��������ʣ�����ȴ���Բ����������ʵķ������±��в���ȷ���ǣ� ��
Na2O2/mol | NaHCO3/mol | ������������ | |
A | 1 | 2 | Na2CO3 |
B | 1.5 | 2 | Na2O2 Na2CO3 |
C | 2 | 1 | Na2O2 NaOH Na2CO3 |
D | 2 | 2 | NaOH Na2CO3 |
A. A B. B C. C D. D
����Ŀ��ij�¶��£���Ӧ��2A��g��B��g��+C��g����ƽ�ⳣ��Ϊ1�����ݻ�Ϊ2L���ܱ������м���A��g����20sʱ��ø���ֵ����ʵ������±�������˵����ȷ���ǣ� ��
���� | A��g�� | B��g�� | C��g�� |
���ʵ���/mol | 1.2 | 0.6 | 0.6 |
A.��Ӧǰ20 s�ڵ�ƽ����Ӧ����Ϊv��A��=0.6 molL��1s��1
B.20 sʱ������Ӧ���ʴ����淴Ӧ����
C.�ﵽƽ��ʱ��A��g����ת����Ϊ100%
D.�������¶�ƽ�ⳣ����Ϊ2����Ӧ�ġ�H��0
����Ŀ���ں��ݾ��ȣ�������罻�������������½���2A��g��+B��g��3C��g��+2D��s����Ӧ�����±�����Ͷ�ϣ���Ӧ�ﵽƽ��״̬�������ϵѹǿ���ߣ�
���� | A | B | C | D |
��ʼͶ��/mol | 2 | 2 | 3 | 0 |
�÷�Ӧ��ƽ�ⳣ������ʽΪK= �� �����¶ȣ�ƽ�ⳣ�������������С�����䡱����