题目内容
【题目】为了保护环境,充分利用资源,某研究小组通过如下简化流程,将工业制硫酸的硫铁矿烧渣(铁主要以![]() 存在)转变成重要的工业原料
存在)转变成重要的工业原料![]() (反应条件略)
(反应条件略)
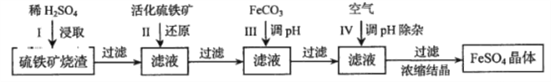
活化硫铁矿还原Fe2+的主要反应为:FeS2+7Fe2(SO4)3+8H2O=15FeSO4+8H2SO4,不考虑其他反应,请回答下列问题:
(1)第Ⅰ步H2SO4与Fe2O3反应的离子方程式是___________________________。
(2)检验第Ⅱ步中Fe3+是否完全还原,应选择(________)(填字母编号)。
A.KMnO4溶液 B.淀粉-KI溶液 C.KSCN溶液
(3)第Ⅲ步加FeCO3调溶液pH到5.8左右,然后再第VI步通入空气使溶液pH降到5.2,此时Fe2+不沉淀,滤液中铝、硅杂质除尽。通入空气引起溶液pH降低的原因是________________。
(4)FeSO4可转化为FeCO3,FeCO3在空气中加热反应可制得铁系氧化物材料。
已知25℃,101kPa时:
4Fe(s)+3O2(g)=2Fe2O3(s) ΔH=-1648kJ/mol
C(s)+O2(g)=CO2(g) ΔH=-393kJ/mol
2Fe(s)+2C(s)+3O2(g)=2FeCO3(s) ΔH=-1480kJ/mol
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是______________。
(5)FeSO4在一定条件下可制得FeS2(二硫化亚铁)纳米材料。该材料可用于制造高容量锂电池,电池放电时的总反应为4Li+FeS2=Fe+2Li2S,正极反应式是________________________。
【答案】 Fe2O3+6H+=2Fe3++3H2O BC Fe2+被氧化为Fe3+,Fe3+水解产生H+ 4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g) ΔH=-260kJ/mol FeS2+4e-=Fe +2S2-
【解析】硫铁矿烧渣用硫酸浸取,过滤后滤液中含有硫酸铁、未反应的硫酸,用活化硫铁矿还原Fe3+后过滤,向滤液中加入FeCO3调节溶液pH,过滤后在通入空气、调节溶液pH,除去溶液中杂质离子,过滤浓缩结晶得到FeSO4晶体,则
(1)H2SO4与Fe2O3反应生成硫酸铁与水,反应离子方程式为Fe2O3+6H+=2Fe3++3H2O;(2)铁离子能把碘化钾氧化为单质碘,碘遇淀粉显蓝色,另外铁离子与KSCN反应使溶液显红色,所以检验第Ⅱ步中Fe3+是否完全还原,应选择淀粉-KI溶液或KSCN溶液,答案选BC;(3)空气中的氧气可以将Fe2+离子氧化为Fe3+离子,Fe3+离子水解生成H+,使溶液pH降低;(4)已知:
①4Fe(s)+3O2(g)=2Fe2O3(s) ΔH=-1648kJ/mol
②C(s)+O2(g)=CO2(g) ΔH=-393kJ/mol
③2Fe(s)+2C(s)+3O2(g)=2FeCO3(s) ΔH=-1480kJ/mol
根据盖斯定律可知①+②×4-③×2即得到FeCO3在空气中加热反应生成Fe2O3的热化学方程式是4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g) ΔH=-260kJ/mol;(5)电池放电时的总反应为:4Li+FeS2=Fe+2Li2S,正极发生还原反应,FeS2获得电子生成Fe、S2-,正极电极反应式为FeS2+4e-=Fe +2S2-。

 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案


