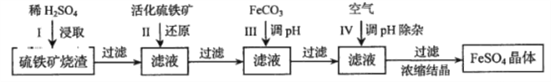
��Ŀ����
����Ŀ�������������
��1���ڼ��ȵ������£���MnO2��100mL���ʵ���Ũ��Ϊ12mol/L��Ũ���ᷴӦ���Ƶ�����2.24L����״������Ӧ����ʽΪMnO2+4HCl��Ũ�� ![]() MnCl2+Cl2��+2H2O������˫���ŷ�����÷�Ӧ�ĵ���ת�Ƶķ������Ŀ ��
MnCl2+Cl2��+2H2O������˫���ŷ�����÷�Ӧ�ĵ���ת�Ƶķ������Ŀ ��
��2��������Ӧ�Ļ�ԭ����������ԭ��Ԫ���� ��
��3����Ҫ����MnO2���ٿˣ�����Ӧ����Һ��������䣬��Ӧ����Һ��Cl�����ʵ���Ũ���Ƕ��٣������ڴ����д��������̣�
���𰸡�
��1��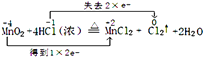
��2��HCl��Mn
��3���⣺n��Cl2��= ![]() =0.1mol��
=0.1mol��
MnO2+ | 4HCl��Ũ�� |
| MnCl2+ | Cl2��+ | 2H2O |
87g | 1mol | ||||
m | 0.1mol |
m=8.7g��
�ָ�����ԭ���غ㣬��Ӧ����Һ��Cl�����ʵ���Ũ���� ![]() =10mol/L
=10mol/L
����Ҫ����MnO28.7g����Ӧ����Һ��Cl�����ʵ���Ũ����10mol/L
���������⣺��1����Ӧ��MnԪ�ػ��ϼ۽��ͣ����ϼ���+4�۽��͵�+2�ۣ�ClԪ�ػ��ϼ����ߣ��ɩ�1�����ߵ�0�ۣ�������ԭ��Ӧ�е�ʧ������Ŀ��ȣ�����Ϊ���ϼ�������������ȣ��ɱ�ʾΪ 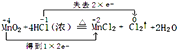 ����
���� ![]() ����2����Ӧ��MnԪ�ػ��ϼ۽��ͱ���ԭ��ClԪ�ػ��ϼ����ߣ���HClΪ��ԭ�������Դ��ǣ�HCl��Mn��
����2����Ӧ��MnԪ�ػ��ϼ۽��ͱ���ԭ��ClԪ�ػ��ϼ����ߣ���HClΪ��ԭ�������Դ��ǣ�HCl��Mn��

��ϰ��ϵ�д�
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
�����Ŀ