��Ŀ����
����Ŀ����(Ti)����Ϊ21���ͽ�����ұ���ѵ���Ҫԭ���Ǻ�Fe2O3��������(FeTiO3)����������
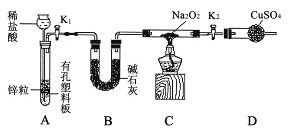
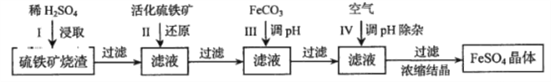
����ͼ��

��֪��TiOSO4������ˮ����ˮ�⣬H2TiO3������ˮ���Իش��������⣺
��1������������Ҫʵ���������ȴ���ᾧ��_________����������ƣ�����������ʵ�����г����Լ�����___________�����������ƣ��м�ǿ�ȡ�
��2���������м�����ˮ��������__________________________________��
��3����������������������(FeSO47H2O)�ڿ����������������졢ˮ����������д���÷�Ӧ�Ļ�ѧ����ʽ______________________________________________________________��
��4�����������õ���������������(FeSO47H2O)��Ŀǰ��ҵ�ϴ��������ж���ˮ���õĻ�ѧ�Լ������߷�Ӧ��(Cr��+6��ת��Ϊ+3��)����ת��Ϊ����Ҫ��ҵ��ֵ�������帴��������(����FeOFeyCrxO3��ʾ)�����Ʊ��������帴����������������Եĺ�����ˮ�У�����FeSO47H2O�����ʵ���ӦΪ��ˮ�����۸�(�൱��CrO3)�����ʵ�����__________����
���𰸡� ���� ���� ���ȡ�ϡ�������ڴ�ʹTiO2+ˮ������H2TiO3 4FeSO47H2O+O2����2Fe2O3+4SO3+28H2O 5
�������������������1���ᾧ���������壬����Ϊ���ˣ����վ���ʧȥ�ᾧˮ�������н��У�
��2��TiO2+����H2TiO3�����ӷ���ʽΪTiO2++2H2O��H2TiO3��+2H+��
��3����������ԭԭ������Ӧ������������Ӧ�Ļ�ѧ����ʽΪ4FeSO4��7H2O+O2![]() 2Fe2O3+4SO3+28H2O��
2Fe2O3+4SO3+28H2O��
��4��FeOFeyCrxO3�У�CrΪ+3�ۣ�FeΪ+3�ۣ���x+y��2�����ݵ��ӵ�ʧ�غ���Fe��Cr��3��1��������x��0.5��y��1.5�����Եó����Ĺ�ϵΪ2.5FeSO47H2O��0.5CrO3�������ʵ���֮�ȱ�Ϊ5��1��