题目内容
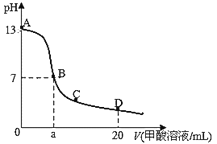
【题目】已知水的电离平衡曲线如图示,试回答下列问题:
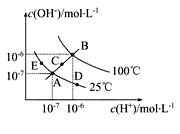
(1)图中五点Kw间的关系是_________。
(2)若从A点到D点,可采用的措施是_________。
A 升温 B 加入少量的盐酸 C 加入少量的NH4Cl
(3)B对应温度下,将pH=11的苛性钠溶液V1 L与0.05mol/L的稀硫酸V2L 混合(设混合前后溶液的体积不变),所得混合溶液的pH=2,则 V1∶V2=________________。
(4)常温下,将V mL、0.1000mol·L-1氢氧化钠溶液逐滴加入到20.00mL、0.1000mol·L-1醋酸溶液中充分反应。请回答下列问题(忽略溶液体积的变化)
①如果溶液pH=7,此时V的取值___________20.00(填“>”“<”或“=”)。而溶液 中c(Na+)、c(CH3COO-)、c(H+)、c(OH-)的大小关系为___________。
②如果V=40.00,则此时溶液中c(OH-)-c(H+)-c(CH3COOH)=________mol·L-1(填数据)
(5)在0.10 mol·L-1硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=____________mol·L-1。(Ksp[Cu(OH)2]=2.2×10-20)
【答案】E=A=D<C<B BC 9:11 < c(Na+)=c(CH3COO-)>c(H+)=c(OH-) 0.033或1/30 2.2×10–8
【解析】
(1)水的离子积常数只与温度有关,温度越高,离子积常数越大;
(2)从A点到D点c(H+)变大,c(OH-)变小,但Kw不变;
(3)该温度下水的离子积为Kw=1×10-12,酸和碱混合,0.05mol/L的稀硫酸溶液中氢离子浓度为1mol/L,若所得混合液的pH=2,则酸过量,根据c(H+)=![]() 计算,列式计算pH,可计算体积比;
计算,列式计算pH,可计算体积比;
(4)①溶液的酸碱性是根据溶液中H+浓度与OH-浓度的相对大小判断的,只要溶液中c(H+)=c(OH-),溶液就呈中性,CH3COOH是弱电解质,电离程度不大,NaOH是强电解质,完全电离,反应生成的乙酸钠是强碱弱酸盐水解呈碱性,需溶液呈中性,需少加碱;根据溶液呈中性pH=7,c(H+)=c(OH-)结合电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-)进行解答;
②根据电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-),物料守恒c(Na+)=2[c(CH3COO-)+c(CH3COOH)]进行解答;
(5)根据溶度积常数及溶液中氢氧根离子浓度计算出c(Cu2+);
(1)水的离子积常数只与温度有关,温度越高,离子积常数越大,同一曲线是相同温度,根据图知,温度高低点顺序是B>C>A=D=E,所以离子积常数大小顺序是B>C>A=D=E;
(2)在A点时,c(H+)=c(OH),溶液显中性,而到D点c(H+)变大,c(OH)变小,溶液显酸性,即由A点到D点,溶液由中性变为酸性,但Kw不变。
A.升高温度,Kw变大,故A错误;
B.加入HCl,则溶液显酸性,故B正确;
C.加入氯化铵,水解显酸性,且Kw不变,故C正确;
故答案为:BC;
(3)该温度下水的离子积为Kw=1×1012,将pH=11的苛性钠中氢氧根离子浓度为:c(OH)=![]() mol/L=0.1mol/L,0.05mol/L的稀硫酸溶液中氢离子浓度为1mol/L,pH=2的溶液中氢离子浓度为0.01mol/L,则混合液中满足:0.1mol/L×V20.1mol/L×V1=0.01mol/L×(V1+V2),整理可得:V1:V2=9:11;
mol/L=0.1mol/L,0.05mol/L的稀硫酸溶液中氢离子浓度为1mol/L,pH=2的溶液中氢离子浓度为0.01mol/L,则混合液中满足:0.1mol/L×V20.1mol/L×V1=0.01mol/L×(V1+V2),整理可得:V1:V2=9:11;
(4)①CH3COOH是弱电解质,电离程度不大,NaOH是强电解质,完全电离,反应生成的乙酸钠是强碱弱酸盐,水解呈碱性,需溶液呈中性pH=7,需少加碱,所以常温下,将VmL、0.1000molL1氢氧化钠溶液逐滴加入到20.00mL、0.1000molL1醋酸溶液中,充分反应,V<20.00mL溶液呈中性pH=7,c(H+)=c(OH);根据电荷守恒c(Na+)+c(H+)=c(CH3COO)+c(OH),c(H+)=c(OH),溶液中的溶质为乙酸钠溶液,水的电离是微弱的,所以c(Na+)=c(CH3COO)>c(H+)=c(OH);
②根据电荷守恒c(Na+)+c(H+)=c(CH3COO)+c(OH),物料守恒c(Na+)=2[c(CH3COO)+c(CH3COOH)],得到c(H+)+c(CH3COO)+2c(CH3COOH)=c(OH),则c(OH)c(H+)c(CH3COOH)=c(CH3COO)+c(CH3COOH),反应后溶液的体积变为60mL,则c(CH3COO)+c
(5)根据题给Cu(OH)2的溶度积即可确定pH=8时,c(OH-)=10-6mol/L,Ksp[Cu(OH)2]=2.2×10-20,则:c(Cu2+)=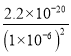 =2.2×10-8molL-1。
=2.2×10-8molL-1。

 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案【题目】下列实验操作能达到实验目的或得出相应结论的是
实 验 操 作 | 目的或结论 | |
A | 将Cu片放入FeCl3溶液中 | 证明Fe的金属性比Cu强 |
B | 将点燃的镁条置于盛有CO2的集气瓶中,瓶内壁有黑色固体生成 | 镁与CO2发生置换反应 |
C | 将SO2通入溴水或酸性高锰酸钾溶液中 | 证明SO2有漂白性 |
D | 向FeCl2溶液(含少量FeBr2杂质)中,加入适量氯水,再加CCl4萃取分液 | 除去FeCl2溶液中的FeBr2 |
A. A B. B C. C D. D