题目内容
14.关于SO2的叙述,不正确的是( )| A. | 造成“酸雨”的罪魁祸首 | B. | 水溶液呈碱性 | ||
| C. | 可以是品红溶液褪色 | D. | 可以使澄清的石灰水变浑浊 |
分析 A.形成酸雨的主要成分是二氧化硫、氮氧化物;
B.二氧化硫的水溶液呈酸性;
C.二氧化硫能使品红溶液褪色;
D.二氧化硫能和澄清石灰水反应生成难溶性固体亚硫酸钙.
解答 解:A.形成酸雨的主要成分是二氧化硫、氮氧化物,所以二氧化硫是造成酸雨的罪魁祸首,故A正确;
B.二氧化硫和水反应生成亚硫酸,亚硫酸电离出氢离子而导致它的水溶液呈酸性,故B错误;
C.二氧化硫能和有色物质反应生成无色物质而具有漂白性,所以能使品红溶液褪色,故C正确;
D.二氧化硫能和澄清石灰水反应生成难溶性固体亚硫酸钙,所以二氧化硫能使澄清石灰水变浑浊,故D正确;
故选B.
点评 本题考查二氧化硫的性质,二氧化硫属于酸性氧化物,具有漂白性、氧化性和还原性,易错选项是D,注意二氧化硫、二氧化碳不能用澄清石灰水鉴别,为易错点.

练习册系列答案
相关题目
4.航天科学技术测得,三氧化二碳(C2O3) 是金星大气层的成分之一.下列说法正确的是( )
| A. | C2O3和CO2是同素异形体 | B. | C2O3和CO完全燃烧,产物都是CO2 | ||
| C. | C2O3和CO 都是酸性氧化物 | D. | C2O3和CO2都是碳酸的酸酐 |
8.某小组利用如图装置,用苯与溴在FeBr3催化作用下制备溴苯:
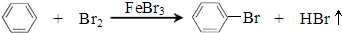
反应剧烈进行,烧瓶中有大量红棕色蒸气,锥形瓶中导管口有白雾出现,蒸馏水逐渐变成黄色.反应停止后按 如下流程分离产品:
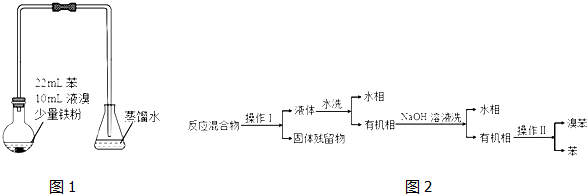
已知:
(1)操作Ⅰ为过滤,操作Ⅱ为蒸馏.
(2)“水洗”、“NaOH溶液洗”需要用到的玻璃仪器是分液漏斗、烧杯.
(3)“水洗”主要目的是除去FeBr3,“NaOH溶液洗”主要目的是除去Br2.
(4)锥形瓶中蒸馏水变黄的原因是溶解了从烧瓶中挥发出的溴.
(5)已知苯与溴发生的是取代反应,推测反应后锥形瓶中液体含有的两种大量离子是Br-、H+,请设计实验方案验证你的推测.(限选试剂:镁条、四氯化碳、氯水、溴水、蒸馏水)
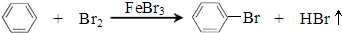
反应剧烈进行,烧瓶中有大量红棕色蒸气,锥形瓶中导管口有白雾出现,蒸馏水逐渐变成黄色.反应停止后按 如下流程分离产品:

已知:
| 沸点℃ | 密度g/cm3 | 溶解性 | |
| 溴 | 59 | 3.119 | 水中溶解度小,易溶于有机溶剂 |
| 苯 | 80 | 0.8765 | 难溶于水,与有机溶剂互溶 |
| 溴苯 | 156 | 1.50 | 难溶于水,与有机溶剂互溶 |
(2)“水洗”、“NaOH溶液洗”需要用到的玻璃仪器是分液漏斗、烧杯.
(3)“水洗”主要目的是除去FeBr3,“NaOH溶液洗”主要目的是除去Br2.
(4)锥形瓶中蒸馏水变黄的原因是溶解了从烧瓶中挥发出的溴.
(5)已知苯与溴发生的是取代反应,推测反应后锥形瓶中液体含有的两种大量离子是Br-、H+,请设计实验方案验证你的推测.(限选试剂:镁条、四氯化碳、氯水、溴水、蒸馏水)
| 序号 | 实验步骤 | 预期现象 | 结论 |
| 1 | 将锥形瓶中液体转入分液漏斗,加入适量四氯化碳,振荡后分液.分别取少量上层无色溶液于试管A、B中 | ||
| 2 | 锥形瓶中液体含大量 Br- | ||
| 3 | 锥形瓶中液体含大量 H+ |
5.可以鉴别乙醇、苯酚、硝酸银、纯碱、氢硫酸五种物质的一种试剂是( )
| A. | 稀盐酸 | B. | 溴水 | C. | 酸性高锰酸钾 | D. | 氯化铁溶液 |
6.青石棉(cricidolite)是一种致癌物质,是《鹿特丹公约》中受限制的46种化学品之一,其化学式为:Na2Fe5Si8O22(OH)2.青石棉用稀硝酸溶液处理时,还原产物只有NO,下列说法不正确的是( )
| A. | 青石棉可能是一种硅酸盐 | |
| B. | 青石棉中含有一定量的石英晶体 | |
| C. | 青石棉能和18molHNO3反应 | |
| D. | 青石棉的化学组成可表示为:Na2O•3FeO•Fe2O3•8SiO2•H2O |
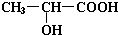 ;
;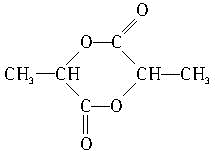 .
.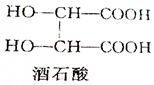 酒石酸的结构简式如图所示,它是葡萄酒中主要的有机酸之一,其主要用途是作饮料添加剂.写出酒石酸的分子式C4H6O6.
酒石酸的结构简式如图所示,它是葡萄酒中主要的有机酸之一,其主要用途是作饮料添加剂.写出酒石酸的分子式C4H6O6.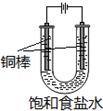 CuCl是应用广泛的有机合成催化剂,可采取不同方法制取.
CuCl是应用广泛的有机合成催化剂,可采取不同方法制取. [CuCl3]2-(无色溶液)逆向移动,生成CuCl.
[CuCl3]2-(无色溶液)逆向移动,生成CuCl.