题目内容
【题目】某校化学兴趣小组为研究氯气的性质,设计如图所示装置进行实验,装置Ⅲ中夹持装置已略去,其中a为干燥的品红试纸,b为湿润的品红试纸.
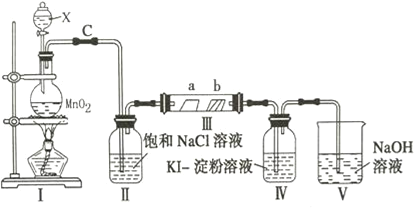
(1)写出仪器X的名称__________________.
(2)加入药品前,检查Ⅰ中气体发生装置气密性的操作是:用止水夹夹住C处_________________
(3)写出装置Ⅰ中发生反应的离子方程式_______________________________________
(4)实验过程中,装置Ⅳ中的实验现象为______________________________________
(5)实验过程中,该组同学在装置Ⅲ中观察到b的红色褪去,但是并未观察到“a无明显变化”这一预期现象的原因是______________________________________,为达到预期现象,应如何改进装置___.
【答案】分液漏斗 橡皮管,然后向分液漏斗中加水,打开分液漏斗活塞,液体不能顺利流下则气密性好 MnO2+4H++2Cl﹣![]() Mn2++Cl2↑+2H2O 无色溶液变蓝色 氯气中的水蒸气 在Ⅱ和Ⅲ之间可加浓硫酸干燥装置,来干燥Cl2
Mn2++Cl2↑+2H2O 无色溶液变蓝色 氯气中的水蒸气 在Ⅱ和Ⅲ之间可加浓硫酸干燥装置,来干燥Cl2
【解析】
制备实验或实验性质的验证,一般遵循的步骤是制气装置→除杂装置→收集装置或验证性质的装置→尾气处理装置,据此分析;
(1)根据装置图,仪器X为分液漏斗;
(2)检验装置I的气密性,操作方法是用止水夹夹住C处橡皮管,然后向分液漏斗中加水,打开分液漏斗活塞,液体不能顺利滴下则气密性良好;或向装置II加入蒸馏水没过长导管,关闭分液漏斗的活塞,微热圆底烧瓶,装置II导管口有气泡冒出,停止加热,长导管口有液柱,说明气密性良好;
(3)装置I制取氯气,其离子方程式为MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(4)Cl2的氧化性强于I2,能将I-氧化成I2,淀粉遇碘单质变蓝,即装置IV中的现象是无色溶液变蓝色;
(5)干燥的氯气不具有漂白性,气体通过装置II,只是除去氯气中氯化氢,即装置II中出来的氯气中含有水蒸气,能使a处品红试纸褪色,因此需要在装置II和III之间可加干燥装置除去氯气中的水蒸气。

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案【题目】在进行化学实验时,经常会有与预期不符的现象出现。某化学实验小组在实验室进行铁盐与亚铁盐相互转化的实验,就出现了与预设不太一致的现象。
实验I:将Fe3+转化为Fe2+
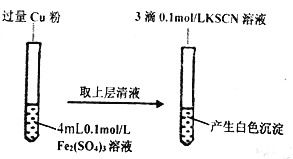
(1)Fe3+与Cu粉发生反应的离子方程式为_________________________________。
(2)该小组同学用对比实验法探究白色沉淀产生的原因,请将其方案补充完整:
实验方案 | 现象 | 结论 |
步骤1:取4mL_________mol/ L CuSO4溶液,向其中滴加3滴0.1mo/ L KSCN溶液 | 产生白色沉淀 | Cu SO4与KSCN反应产生了白色沉淀 |
步骤2:取4mL0.2mol/ L FeSO4溶液,向其中滴加3滴0.1mol/ L KSCN溶液 | ___________ |
查阅资料:①SCN-的化学性质与I-相似 ②2Cu2++4I-=2CuI↓+I2
③(SCN)2的化学性质与I2相似
则Cu2+与SCN-反应的离子方程式为____________________________________________。
实验Ⅱ:将Fe2+转化为Fe3+
实验方案 | 现象 |
向3mL0.1mol/L FeSO4溶液中加入lmL8mol/L稀硝酸 | 溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色 |
探究上述现象出现的原因:
查阅资料:Fe2++NO![]() Fe(NO)2+(棕色) ②Fe(NO)2+与HNO3不反应
Fe(NO)2+(棕色) ②Fe(NO)2+与HNO3不反应
(3)用离子方程式解释NO产生的原因____________________________________________。
(4)从化学反应速率与限度的角度对体系中存在的反应进行
反应I:Fe2+与HNO3反应; 反应Ⅱ:Fe2+与NO反应
①依据实验现象,甲认为反应I的速率比反应Ⅱ___________(填“快”或“慢”)。
②乙认为反应I是一个不可逆反应,并通过实验证明其猜测正确,乙设计的实验方案是_______________________________________________________。
③请用化学平衡移动原理解释溶液由棕色变为黄色的原因______________________。
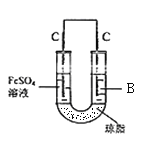
(5)丙认为若生成的NO与Fe2+不接触,溶液就不会出现棕色,他利用实验室常用的仪器和药品设计并完成了如图所示的实验,实现了Fe2+![]() Fe3+的转化,同时避免出现此异常现象。实验发现:U形管右侧有气泡,U形管左侧的现象为___________、B溶液是___________溶液(填化学式)。
Fe3+的转化,同时避免出现此异常现象。实验发现:U形管右侧有气泡,U形管左侧的现象为___________、B溶液是___________溶液(填化学式)。