题目内容
【题目】在进行化学实验时,经常会有与预期不符的现象出现。某化学实验小组在实验室进行铁盐与亚铁盐相互转化的实验,就出现了与预设不太一致的现象。
实验I:将Fe3+转化为Fe2+
(1)Fe3+与Cu粉发生反应的离子方程式为_________________________________。
(2)该小组同学用对比实验法探究白色沉淀产生的原因,请将其方案补充完整:
实验方案 | 现象 | 结论 |
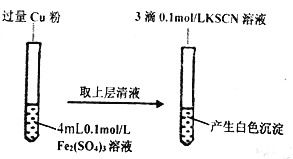
步骤1:取4mL_________mol/ L CuSO4溶液,向其中滴加3滴0.1mo/ L KSCN溶液 | 产生白色沉淀 | Cu SO4与KSCN反应产生了白色沉淀 |
步骤2:取4mL0.2mol/ L FeSO4溶液,向其中滴加3滴0.1mol/ L KSCN溶液 | ___________ |
查阅资料:①SCN-的化学性质与I-相似 ②2Cu2++4I-=2CuI↓+I2
③(SCN)2的化学性质与I2相似
则Cu2+与SCN-反应的离子方程式为____________________________________________。
实验Ⅱ:将Fe2+转化为Fe3+
实验方案 | 现象 |
向3mL0.1mol/L FeSO4溶液中加入lmL8mol/L稀硝酸 | 溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色 |
探究上述现象出现的原因:
查阅资料:Fe2++NO![]() Fe(NO)2+(棕色) ②Fe(NO)2+与HNO3不反应
Fe(NO)2+(棕色) ②Fe(NO)2+与HNO3不反应
(3)用离子方程式解释NO产生的原因____________________________________________。
(4)从化学反应速率与限度的角度对体系中存在的反应进行
反应I:Fe2+与HNO3反应; 反应Ⅱ:Fe2+与NO反应
①依据实验现象,甲认为反应I的速率比反应Ⅱ___________(填“快”或“慢”)。
②乙认为反应I是一个不可逆反应,并通过实验证明其猜测正确,乙设计的实验方案是_______________________________________________________。
③请用化学平衡移动原理解释溶液由棕色变为黄色的原因______________________。
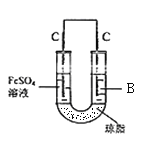
(5)丙认为若生成的NO与Fe2+不接触,溶液就不会出现棕色,他利用实验室常用的仪器和药品设计并完成了如图所示的实验,实现了Fe2+![]() Fe3+的转化,同时避免出现此异常现象。实验发现:U形管右侧有气泡,U形管左侧的现象为___________、B溶液是___________溶液(填化学式)。
Fe3+的转化,同时避免出现此异常现象。实验发现:U形管右侧有气泡,U形管左侧的现象为___________、B溶液是___________溶液(填化学式)。
【答案】2Fe3++Cu═2Fe2++Cu2+ 0.1 无明显现象 2Cu2++4SCN-=2CuSCN↓+(SCN)2 3Fe2++4H++NO3-=3Fe3++NO↑+2H2O 慢 取反应后的黄色溶液少量于一支试管中,向其中加入几滴K3[Fe(CN)6]溶液,溶液无明显变化,说明反应I是不可逆反应 Fe2+被硝酸氧化为Fe3+,导致溶液中Fe2+浓度降低,平衡Fe2++NO![]() Fe(NO)2+逆向移动,最终Fe(NO)2+转化为Fe3+,溶液由棕色变为黄色 溶液由浅绿色变为黄色 HNO3
Fe(NO)2+逆向移动,最终Fe(NO)2+转化为Fe3+,溶液由棕色变为黄色 溶液由浅绿色变为黄色 HNO3
【解析】
(1)Fe3+与Cu粉发生反应生成铜离子与亚铁离子;
(2)图1中得到溶液中Fe2+为0.2mol·L-1,Cu2+为0.1mol·L-1,分别取相同浓度的硫酸铜溶液、硫酸亚铁溶液,滴入KSCN溶液进行对照实验;
由题目信息①SCN-的化学性质与I-相似 ②2Cu2++4I-=2CuI↓+I2,可知,Cu2+与SCN-反应生成CuSCN沉淀,同时生成(SCN)2;
(3)亚铁离子具有还原性,酸性条件下硝酸根具有强氧化性,反应生成铁离子、NO与水;
(4)①依据实验现象,先看到溶液变为棕色,甲认为反应I的速率比反应Ⅱ慢;
②反应Ⅰ是一个不可逆反应,设计实验方案加以证明取反应后的黄色溶液少量于一支试管中,向其中加入几滴K3[Fe(CN)6]溶液,溶液无明显变化,说明反应I是不可逆反应;
③Fe2+被硝酸氧化为Fe3+,导致溶液中Fe2+浓度降低,导致平衡发生移动,最终Fe(NO)2+完全转化为Fe3+。
(5)利用原电池原理,使NO与Fe2+在不同的电极区域生成。
(1)Fe3+与Cu粉发生反应生成铜离子与亚铁离子,反应离子方程式为:2Fe3++Cu═2Fe2++Cu2+;
(2)由反应2Fe3++Cu═2Fe2++Cu2+,可知图1中得到溶液中Fe2+为0.2mol·L-1,Cu2+为0.1mol·L-1,分别取相同浓度的硫酸铜溶液、硫酸亚铁溶液,滴入KSCN溶液进行对照实验,故实验方案为:
步骤1:取4mL 0.1mol·L-1 CuSO4溶液,向其中滴加3滴0.1mol·L-1 KSCN溶液;
步骤2:取4mL 0.2mol·L-1 FeSO4溶液,向其中滴加3滴0.1mol·L-1 KSCN溶液,无明显现象。
由题目信息①SCN-的化学性质与I-相似 ②2Cu2++4I-=2CuI↓+I2,可知,Cu2+与SCN-反应生成CuSCN沉淀,同时生成(SCN)2,反应离子方程式为:2Cu2++4SCN-=2CuSCN↓+(SCN)2;
(3)亚铁离子具有还原性,酸性条件下硝酸根具有强氧化性,反应生成铁离子、NO与水,反应离子方程为:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O;
(4)①依据实验现象,先看到溶液变为棕色,甲认为反应I的速率比反应Ⅱ慢;
②反应中硝酸过量,若存在平衡,溶液中含有Fe2+,否则没有Fe2+,具体的实验方案是:取反应后的黄色溶液少量于一支试管中,向其中加入几滴K3[Fe(CN)6]溶液,溶液无明显变化,说明反应I是不可逆反应;
③Fe2+被硝酸氧化为Fe3+,导致溶液中Fe2+浓度降低,平衡Fe2++NO![]() Fe(NO)2+逆向移动,最终Fe(NO)2+转化为Fe3+,溶液由棕色变为黄色。
Fe(NO)2+逆向移动,最终Fe(NO)2+转化为Fe3+,溶液由棕色变为黄色。
(5)利用原电池原理,使NO与Fe2+在不同的电极区域生成,U形管右侧有气泡,U形管左侧的现象为溶液由浅绿色变为黄色、B溶液是稀硝酸溶液,化学式为HNO3。

【题目】(1)在一定条件下氨气和氧气能发生反应生成氮气和水蒸气:4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H
查阅资料可得有关的化学键键能数据如下:
化学键 | N≡N | H-O | N-H | O=O |
E/ (kJ·mol-1) | 946 | 463 | 391 | 496 |
由此计算上述反应的反应热△H=___________kJ·mol-1。
(2)已知:N2(g)+O2(g)=2NO(g) K1
N2(g)+3H2(g)=2NH3(g) K2
2H2(g)+O2(g)=2H2O(g) K3
注:K1、K2、K3分别为上述三个反应的平衡常数
回答下列问题:
①氨催化氧化反应(生成气态水)的平衡常数K为___________(用K1、K2、K3表示)。
②一定条件下,将4molNH3和5.2molO2混合于容积为4L的恒容密闭容器中发生催化氧化反应,经过10s后达到平衡,测得NO的浓度为0.4mol/L则0到10s内,用NH3表示该反应的平均反应速率为___________,O2的转化率为___________(用百分数表示,且保留小数点后一位),该反应的平衡常数为___________(列出计算式即可)。
③若上述反应第一次达到平衡时,保持其他条件不变的情况下,只是将容器的体积扩大一倍,假定在25s后达到新的平衡。请在下图中用曲线表示15~30s这个阶段体系中NH3的浓度随时间变化的趋势。__________

(3)下列有关该反应的说法正确的是___________(填字母)。
A.恒温恒容,再充入4molNH3和5.2molO2,再次达到平衡时,NH3的转化率增大
B.恒温恒容,当容器内的密度保持不变时,反应达到了平衡
C.当混合气体的平均摩尔质量不变时,反应达到了平衡
D.当2v正(NO)=3v逆(H2O)时,反应达到了平衡
(4)工业上常用氨水吸收SO2,可生成(NH4)2SO3,请判断常温下(NH4)2SO3溶液的酸碱性并通过计算说明判断依据:_______________________________________________________。(已知:NH3·H2O的Kb=1.8×10-5;H2SO3的Ka1=1.3×10-2,Ka2=6.3×10-8)