题目内容
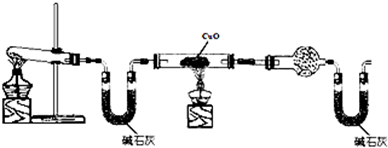
19.氨是一种重要的化工原料,某学习小组同学设计了如图所示的实验装置(部分夹持仪器未画出),探究氨气的还原性并检验产物.实验现象为:黑色CuO变为红色;白色无水CuSO4粉末变为蓝色;同时生成一种无色气体,该气体无污染.
(1)请写出大试管中反应的化学方程式2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O
(2)请写出氨气与CuO反应的化学方程式3CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O
(3)该装置存在明显缺陷,请指出存在的问题此装置没有尾气吸收装置
(4)工业废气中的氮氧化物是主要的大气污染物之一.为了治理污染,工业上常用氨气与之发生反应:NOx+NH3→N2+H2O,使其转化为无毒的N2.现有NO和NO2的混合气体3.0L,跟3.4L(同温同压下)NH3反应,恰好使其全部转化为氮气,则原混合气体中,NO与NO2的体积比是3:7
分析 (1)氢氧化钙与氯化铵在加热条件下生成氨气、氯化钙和水;
(2)氧化铜氧化氨气生成氮气和水、铜;
(3)氨气直接排放能够引起空气污染,应进行尾气处理;
(4)根据方程式3NOx+2xNH3=$\frac{3+2x}{2}$N2+3xH2O计算x值,再利用十字相乘法计算一氧化氮和二氧化氮的体积之比.
解答 解:(1)氢氧化钙与氯化铵在加热条件下生成氨气、氯化钙和水,化学方程式:2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$ CaCl2+2NH3↑+2H2O;
故答案为:2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(2)氧化铜氧化氨气生成氮气和水、铜,化学方程式:3CuO+2NH3 $\frac{\underline{\;\;△\;\;}}{\;}$ 3Cu+N2+3H2O;
故答案为:3CuO+2NH3 $\frac{\underline{\;\;△\;\;}}{\;}$ 3Cu+N2+3H2O;
(3)氨气直接排放能够引起空气污染,应进行尾气处理;
故答案为:此装置没有尾气吸收装置;
(4)解:依据方程式:3NOx+2xNH3=$\frac{3+2x}{2}$N2+3xH2O,
3 2x
3.0L 3.4L
解得:x=1.7;
所以故氮氧化物的分子式为NO1.7,根据氮氧化物的平均化学式计算NO2与NO的体积比,
则: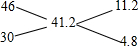 ,
,
所以二氧化氮与一氧化氮体积之比:11.2:4.8=7:3;即,NO与NO2的体积比为3:7;
故答案为:3:7.
点评 本题考查了氨气的制备和性质的检验,依据混合物的有关计算,明确氧化还原反应得失电子守恒是解题关键,题目难度中等.

| A. | 在镍做催化剂的条件下,苯与氢气反应 | |
| B. | 苯与液溴混合后加入铁粉 | |
| C. | 乙烯通入溴水中 | |
| D. | 烧至红热的铜丝插入乙醇中 |
| A. | 氯气溶于水:Cl2+H2O?2H++Cl-+ClO- | |
| B. | Na2CO3溶液中加入少量稀盐酸:CO32-+2H+═CO2↑+H2O | |
| C. | 酸性溶液中KIO3与KI反应生成I2:IO3-+I-+6H+═I2+3H2O | |
| D. | NaHCO3溶液中加足量Ba(OH)2溶液:HCO3-+Ba2++OH-═BaCO3↓+H2O |
| 物质 | M | N | P | Q |
| 反应前质量(g) | 15.8 | 8.4 | 31.6 | 1.6 |
| 一段时间后质量(g) | 待测 | 14 | 21.6 | 6 |
| A. | 该反应类型属置换反应 | B. | 物质P一定是化合物 | ||
| C. | 反应生成的N与Q的质量比为7:3 | D. | M肯定为该反应的催化剂 |
| A. | NO2气体通入FeSO4溶液中 | B. | CO2通入Ba(NO3)2溶液中 | ||
| C. | SO2气体通入Ca(NO3)2溶液中 | D. | CO2气体通入Ca(ClO)2溶液中 |
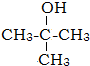 .
.

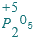 .
.