题目内容
【题目】碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质。请回答下列问题:
(1)有机物M经过太阳光光照可转化成N,转化过程如图:

则M、N相比,较稳定的是 。(用字母“M”或“N”表示)
(2)已知CH3OH(l)的燃烧热△H=-238.6kJ/mol,CH3OH(l)+![]() O2(g)=CO2(g)+2H2(g)△H=-akJ/mol,则a ________238.6(填“>”、“<”或“=”)。
O2(g)=CO2(g)+2H2(g)△H=-akJ/mol,则a ________238.6(填“>”、“<”或“=”)。
(3)使Cl2和H2O(g)通过灼热的炭层生成HCl和CO2,该反应的热化学方程式为____________
2Cl2(g)+2H2O(g)+C(s)=4HCl(g)+CO2(g)△H=-290kJmol﹣1,当有710gCl2参加反应时放出的热量为____________。
(4)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,已知4Al(s)+3TiO2(s)+3C(s) =2Al2O3(s)+3TiC(s) △H=-1176kJ/mol,则反应过程中,每转移5mol电子放出的热量为 kJ。
【答案】(1)M;(2)﹤;(3)1450kJ;(4)490。
【解析】
试题分析:(1)此反应是吸热反应,M的能量低于N,能量越低,物质越稳定,因此M稳定;(2)甲醇燃烧生成CO2和液态水,氢气还能燃烧,因此a<238.6kJ;(3)放出的热量是710×290/(35.5×4)kJ=1450kJ;(4)根据反应方程式,Al的化合价升高,C的化合价降低,因此4molAl参加反应,转移电子4×3mol=12mol,因此转移5mol电子,产生热量是为5×1176/12kJ=490kJ。

【题目】(12分)中和热的测定是高中重要的定量实验。取0.55 mol/L的NaOH溶液50 mL与0.50 mol/L的盐酸50 mL置于图所示的装置中进行中和热的测定实验,回答下列问题
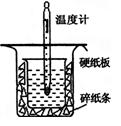
(1)从上图实验装置看,其中尚缺少的一种玻璃用品是_________ _,除此之外,装置中的一个明显错误是 。
(2)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热数值会_________,(填“偏大”、“偏小”或“不变”)。
(3)实验中改用60 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1 NaOH溶液进行反应,与上述实验相比,所求中和热 (填“相等”或“不相等”),简述理由: 。
(4)某实验小组用盐酸和氢氧化钠溶液做了三次实验,每次取溶液各50 mL,并记录下原始数据:
实验序号 | 起始温度t1/℃ | 终止温度(t2)/℃ | 温差(t2-t1)/℃ | ||
盐酸 | NaOH溶液 | 平均值 | |||
1 | 25.1 | 24.9 | 25.0 | 28.3 | 3.3 |
2 | 25.1 | 25.1 | 25.1 | 28.6 | 3.5 |
3 | 25.1 | 25.1 | 25.1 | 27.1 | 2.0 |
已知盐酸、NaOH溶液密度近似为1.00 g/cm3,中和后混合液的比热容c=4.18×10-3 kJ/(g·℃),根据计算结果,写出该中和反应的热化学方程式 。
【题目】某实验小组用0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol/L NaOH溶液
若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体 g
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如下图所示。
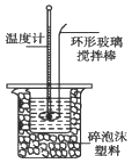
(1)写出该反应的热化学方程式(中和热为57.3 kJ/mol): 。
(2)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
①请填写下表中的空白:
温度 实验 次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
②近似认为0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热△H= (取小数点后一位)。
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是: (填字母)。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度