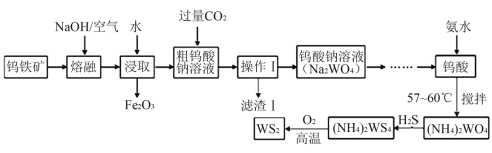
题目内容
【题目】草酸(H2C2O4,二元弱酸)与草酸盐在实验和工业生产中都起着重要的作用。
(1)硫酸酸化的KMnO4能与Na2C2O4溶液反应生成Mn2+和CO2,该反应的离子方程式为__________;
(2)分别使10 mL pH=3的H2C2O4溶液和100 mL pH=4的H2C2O4溶液全部转化为Na2C2O4,所需等浓度的NaOH溶液的体积为V1和V2,则V1_____V2(填“>”“<”或“=”)
(3)常温下,用0.1000 mol/L NaOH溶液滴定20.00 mL某未知浓度的H2C2O4溶液,滴定曲线如图,c点所示溶液中:![]()
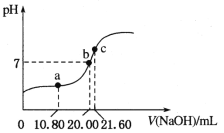
①该草酸溶液的物质的量浓度为__________;
②a点所示溶液中各离子的浓度由大到小的顺序为_________________;
(4)已知:某温度时,Ksp(FeC2O4)=2.0×10-7,Ksp(CaC2O4)=2.5×10-9。
①此温度下,CaC2O4饱和溶液的物质的量浓度为________;
②此温度下,向Na2C2O4溶液中加入FeCl2与CaCl2,当两种沉淀共存时,溶液中c(Fe2+):c(Ca2+)=_____。
【答案】2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O > 0.054 mol/L c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-) 5×10-5 mol/L 80
【解析】
(1)根据KMnO4能与热的经硫酸化的Na2C2O4反应生成Mn2+和CO2,并利用质量守恒定律、电荷守恒、电子守恒来书写离子反应方程式;
(2)相同温度下,酸的浓度越小其电离程度越大,草酸和碱反应消耗碱的物质的量与酸的物质的量成正比;
(3)①用0.1000 mol/LNaOH溶液滴定20.00 mL某未知浓度的H2C2O4溶液,根据c点离子浓度之间的关系,得到c点的溶液是草酸钠的水溶液,根据滴定原理来计算;
②a点所示溶液显示酸性,此时得到的是草酸氢钠溶液,据此回答;
(5)①根据Ksp的意义结合物质的量浓度公式c=![]() 来计算;
来计算;
②根据Ksp表达式得到溶液中c(Fe2+):c(Ca2+)等于Ksp(FeC2O4):Ksp(CaC2O4),据此计算。
由KMnO4能与热的经硫酸化的Na2C2O4反应生成MnSO4和CO2,反应的化学方程式为2KMnO4+5Na2C2O4+8H2SO4=K2SO4+2MnSO4+5Na2SO4+10CO2↑+8H2O,根据物质拆分原则,其离子方程式是:2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O;
(2)相同温度下,酸的浓度越小其电离程度越大,所以pH=3草酸的浓度大于pH=4草酸浓度的10倍,10 mLpH=3的草酸溶液和100 mLpH=4的草酸溶液,前者的物质的量大于后者,草酸和碱反应消耗碱的物质的量与酸的物质的量成正比,所以消耗氢氧化钠体积V1>V2;
(3)①用0.100 mol/LNaOH溶液滴定20.00 mL某未知浓度的H2C2O4溶液,根据c点离子浓度之间的关系,得到c点的溶液是草酸钠的水溶液,草酸和氢氧化钠之间按照1:2物质的量之比进行反应,所以该草酸溶液的物质的量浓度c(H2C2O4)=![]() ≈0.054 mol/L;
≈0.054 mol/L;
②c点为Na2C2O4溶液,此时NaOH溶液的体积是21.60 mL,而a点时NaOH溶液的体积是10.80 mL,恰好是c点消耗的一半,则a点溶液为NaHC2O4溶液;所示溶液显示酸性,说明HC2O4-电离程度大于其水解程度,且溶液中同时存在水电离产生H+,且HC2O4-电离程度远大于水的电离程度,则c(H+)>c(C2O42-)>c(OH-);HC2O4-由于电离、水解消耗,而溶液中Na+不发生任何变化,盐电离产生的离子浓度远大于其电离产生的微粒浓度,所以c(Na+)>c(HC2O4-)>c(H+),故溶液中各离子的浓度由大到小的顺序为c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-);
(4)①已知Ksp(CaC2O4)=2.5×10-9,假设饱和溶液浓度是x,则根据溶度积常数的含义可知Ksp=c(Ca2+)c(C2O42-)=x2=2.5×10-9=25×10-10,所以x=5×10-5 mol/L,溶液的体积是1 L,所溶解的草酸钙的物质的量是5×10-5mol;
②此温度下,向Na2C2O4溶液中加入FeCl2与CaCl2,当两种沉淀共存时,溶液c(Fe2+):c(Ca2+)等于Ksp(FeC2O4):Ksp(CaC2O4)=![]() =80。
=80。

 阅读快车系列答案
阅读快车系列答案【题目】(1)水的电离平衡曲线如图所示,若A点表示25 ℃时水的电离达平衡时的离子浓度,B点表示100 ℃时水的电离达平衡时的离子浓度。则100 ℃时pH=12的NaOH溶液100mL,要使它的pH为11。(体积变化忽略不计)
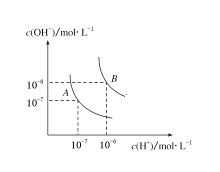
①如果加入蒸馏水,应加_________mL;
②如果加入pH=10的NaOH溶液,应加_________mL;
(2)25 ℃时,向水的电离平衡体系中加入少量NH4Cl固体,对水的电离平衡的影响是________(填“促进”、 “抑制”或“不影响”)。
已知如表数据。
化学式 | 电离平衡常数(25 ℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7 K2=5.6×10-11 |
(3)25 ℃时,有等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三种溶液的pH由大到小的顺序为_________。(填化学式)
(4)25 ℃时,等浓度的CH3COOH溶液和NaOH溶液等体积混合,所得溶液显碱性,则c(Na+)________c(CH3COO-)(填“>”、“<”或“=”)。
(5)向NaCN溶液中通入少量CO2,反应的化学方程式为____________。