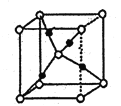
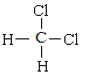
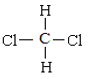
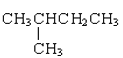题目内容
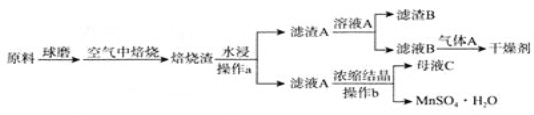
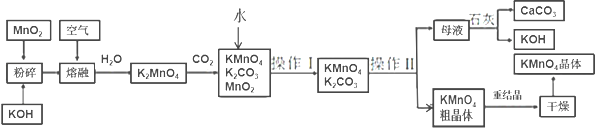
【题目】高锰酸钾是锰的重要化合物和常用的氧化剂。以下是工业上用软锰矿制备高锰酸钾的一种工艺流程:
(1)KMnO4稀溶液是一种常用的消毒剂。其消毒原理与下列________________物质相似。
a.75%酒精 b.双氧水 c.苯酚 d.“84”消毒液(NaClO溶液)
(2)粉碎的目的是________________,操作Ⅰ的名称是________________
(3)上述流程中可以循环使用的物质有石灰、CO2、_________和__________(写化学式)。
(4)向K2MnO4溶液中通入CO2以制备KMnO4,该反应中的还原剂是____________。
(5)铋酸钠(NaBiO3,不溶于水)用于定性检验酸性溶液中Mn2+的存在(铋元素的还原产物为Bi3+,Mn的氧化产物为+7价),写出反应的离子方程式:__________________。
【答案】BD 增大接触面积,加快反应的速率 过滤 KOH MnO2 K2MnO4 2Mn2++5NaBiO3+14H+═2MnO4-+5Bi3++5Na++7H2O
【解析】
二氧化锰与氢氧化钾在空气中熔融,加水溶解得到K2MnO4溶液,通入二氧化碳得到KMnO4、MnO2、K2CO3,过滤除去滤渣(MnO2),滤液为KMnO4、K2CO3溶液,浓缩结晶,趁热过滤得到KMnO4晶体,母液中含有K2CO3,在母液中加石灰乳(氢氧化钙)得到碳酸钙沉淀和KOH,据此分析解答。
(1)KMnO4有强氧化性,利用其强氧化性杀菌消毒,消毒原理与84消毒液、双氧水一样,故答案为:BD;
(2)将二氧化锰与氢氧化钾粉碎,可以增大接触面积,加快后续反应的速率;操作I是分离固体与溶液,因此是过滤,故答案为:增大接触面积,加快反应的速率;过滤;
(3)制备中利用的原料,在转化过程中又生成的可以循环利用。由转化关系图知,除石灰、二氧化碳外,K2MnO4溶液中通入CO2以制备KMnO4生成的MnO2及最后由母液加入石灰生成的KOH,会在MnO2、KOH的熔融制备K2MnO4中被循环利用,故答案为:KOH、MnO2;
(4)由工艺流程转化关系可知,向K2MnO4溶液中通入CO2制备KMnO4、还生成K2CO3、MnO2,反应中只有Mn元素的化合价发生变化,由+6价降低为+4价,由+6价升高为+7价,所以K2MnO4既是氧化剂又是还原剂,故答案为:K2MnO4;
(5)铋酸钠(不溶于水)在酸性溶液中与Mn2+反应生成MnO4-和Bi3+,则反应的离子方程式为:2Mn2++5NaBiO3+14H+═2MnO4-+5Bi3++5Na++7H2O,故答案为:2Mn2++5NaBiO3+14H+═2MnO4-+5Bi3++5Na++7H2O。

【题目】(1)水的电离平衡曲线如图所示,若A点表示25 ℃时水的电离达平衡时的离子浓度,B点表示100 ℃时水的电离达平衡时的离子浓度。则100 ℃时pH=12的NaOH溶液100mL,要使它的pH为11。(体积变化忽略不计)
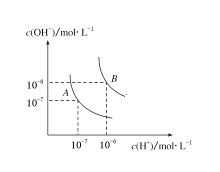
①如果加入蒸馏水,应加_________mL;
②如果加入pH=10的NaOH溶液,应加_________mL;
(2)25 ℃时,向水的电离平衡体系中加入少量NH4Cl固体,对水的电离平衡的影响是________(填“促进”、 “抑制”或“不影响”)。
已知如表数据。
化学式 | 电离平衡常数(25 ℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7 K2=5.6×10-11 |
(3)25 ℃时,有等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三种溶液的pH由大到小的顺序为_________。(填化学式)
(4)25 ℃时,等浓度的CH3COOH溶液和NaOH溶液等体积混合,所得溶液显碱性,则c(Na+)________c(CH3COO-)(填“>”、“<”或“=”)。
(5)向NaCN溶液中通入少量CO2,反应的化学方程式为____________。