题目内容
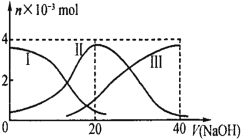
【题目】常温下,向20mL0.2mol·L-1H2B溶液中滴加0.2mol·L-1NaOH溶液。有关微粒的物质的量变化如下图(其中Ⅰ表示H2B,Ⅱ代表HB-、Ⅲ代表B2-),根据图示判断,当V(NaOH)=20mL时,溶液中各粒子浓度的大小顺序正确的是
A. c(Na+)>c(HB-)>c(H+)>c(B2-)>c(H2B)
B. c(Na+)>c(HB-)>c(OH-)>c(H2B)>c(H+)>c(B2-)
C. c(Na+)>c(H+)>c(HB-)>c(B2-)>c(OH-)>c(H2B)
D. c(Na+)>c(OH-)>c(HB-)>c(H2B)>c(H+)>c(B2-)
【答案】A
【解析】
向20mL0.2molL-1H2B溶液中滴加0.2molL-1NaOH溶液,当V(NaOH)=20mL时,两者以1:1物质的量之比发生的反应为:NaOH+H2B=NaHB+H2O;所得溶液为NaHB溶液,依据图象分析,溶液中c(HB-)>c(B2-)>c(H2B),说明HB-的电离程度大于水解程度,据此分析。
向20mL0.2molL-1H2B溶液中滴加0.2molL-1NaOH溶液,当V(NaOH)=20mL时,两者以1:1物质的量之比发生的反应为:NaOH+H2B=NaHB+H2O;所得溶液为NaHB溶液,依据图象分析,溶液中c(HB-)>c(B2-)>c(H2B),说明HB-的电离程度大于水解程度,溶液显酸性,且HB-的电离和水解都是微弱的,溶液中还存在水的电离平衡,所以溶液中各粒子浓度由大到小的顺序为:c(Na+)>c(HB-)>c(H+)>c(B2-)>c(H2B);故A正确。
故选A。

 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案【题目】煤的干馏实验装置如图所示。下列说法错误的是( )

A.c口导出的气体可使新制氯水褪色B.从b层液体中分离出苯的操作是分馏
C.长导管的作用是导气和冷凝D.可用蓝色石蕊试纸检验a层液体中含有的NH3
【题目】研究氮的氧化物、碳的氧化物等大气污染物的处理具有重要意义。
I. 已知:①N2(g)+O2(g)=2NO(g) ΔH=+180.5kJ·mol-1 ②CO的燃烧热△H= - 283 kJ·mol-1
(1)汽车排气管内安装的催化转化器,可使尾气中主要污染物(NO和CO)转化为无毒的大气循环物质,该反应的热化学方程式为_________________________________________________。
(2)一定温度下,在恒容密闭容器中充入1 molNO和2 molCO进行该反应,下列能判断反应达到化学平衡状态的是_______。
①单位时间内消耗a mo1 CO的同时生成2a mol NO
②混合气体的平均相对分子质量不再改变
③混合气体中NO和CO的物质的量之比保持不变
④混合气体的密度不再改变
II. 臭氧是理想的烟气脱硝试剂,其脱硝反应为2NO2(g)+O3(g)![]() N2O5(g)+O2(g),向甲、乙两个体积都为1.0 L的恒容密闭容器中分别充入2.0 mol NO2和1.0 mol O3,分别在T1、T2温度下,经过一段时间后达到平衡。反应过程中n(O2)随时间(t)变化情况见下表:
N2O5(g)+O2(g),向甲、乙两个体积都为1.0 L的恒容密闭容器中分别充入2.0 mol NO2和1.0 mol O3,分别在T1、T2温度下,经过一段时间后达到平衡。反应过程中n(O2)随时间(t)变化情况见下表:
t/s | 0 | 3 | 6 | 12 | 24 | 36 |
甲容器(T1)n(O2)/mol | 0 | 0.36 | 0.60 | 0.80 | 0.80 | 0.80 |
乙容器(T2)n(O2)/mol | 0 | 0.30 | 0.50 | 0.70 | 0.85 | 0.85 |
(3)T1___T2(填>、<或=,下同),该反应ΔH___0 。简述理由________________________________。
(4)甲容器中,0~3s内的平均反应速率v(NO2)=______________________。
(5)甲容器中NO2平衡转化率为________,T1时该反应的平衡常数为_______________________。
III. 将NO2(g)转化为N2O4(g)

(6)石墨I为______极(选填正、负),Y化学式为_________。
(7)II电极反应式为_________________________________________。
【题目】某温度下,H2(g)+CO2(g) ![]() H2O(g)+CO(g)的平衡常数K=9/4,该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示,
H2O(g)+CO(g)的平衡常数K=9/4,该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示,
起始浓度 | 甲 | 乙 | 丙 |
c(H2)(mol/L) | 0.010 | 0.020 | 0.020 |
c(CO2)(mol/L) | 0.010 | 0.010 | 0.020 |
下列判断不正确的是( )
A. 平衡时,乙中H2的转化率大于60%
B. 平衡时,甲中和丙中H2的转化率均是60%
C. 平衡时,丙中c(CO)是甲中的2倍,是0.012 mol/L
D. 反应开始时,丙中的反应速率最快,甲中的反应速率最慢


