题目内容
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.1.8 g NH4+含有的电子数为NA
B.1 L 1 mol·L-1的NaAlO2水溶液中含有的氧原子数为2NA
C.标况下,22.4 L NO与11.2 L O2充分反应后,生成物的分子总数为NA
D.50 mL 18 mol·L-1的浓硫酸与足量的铜片共热,生成SO2的分子数为0.45NA
【答案】A
【解析】
A. 一个NH4+含有10个电子,1.8 g NH4+物质的量为![]() ,因此1.8g NH4+含有的电子物质的量为1mol,数目为NA,故A正确;
,因此1.8g NH4+含有的电子物质的量为1mol,数目为NA,故A正确;
B. 1 L 1 mol·L1的NaAlO2水溶液中n(NaAlO2) = 1 L ×1 mol·L1=1mol,NaAlO2中含有的氧原子物质的量为2mol,溶液中水还含有氧原子,因此溶液中氧原子物质的量大于2mol,氧原子数目大于2 NA,故B错误;
C. 标况下,22.4 L NO即物质的量为![]() 与11.2 L O2即物质的量为
与11.2 L O2即物质的量为![]() ,发生2NO + O2 = 2NO2,即生成1molNO2,由于2NO2
,发生2NO + O2 = 2NO2,即生成1molNO2,由于2NO2![]() N2O4,因此生成物的分子总数小于NA,故C错误;
N2O4,因此生成物的分子总数小于NA,故C错误;
D. 50 mL 18 mol·L1的浓硫酸即物质的量n(H2SO4) = 0.05 L ×18 mol·L1=0.9 mol,与足量的铜片共热,根据Cu + 2H2SO4(浓) ![]() CuSO4+ SO2↑+ 2H2O和浓硫酸反应过程中逐渐变稀,稀硫酸不与铜反应,因此生成SO2的分子数小于0.45 NA,故D错误。
CuSO4+ SO2↑+ 2H2O和浓硫酸反应过程中逐渐变稀,稀硫酸不与铜反应,因此生成SO2的分子数小于0.45 NA,故D错误。
答案为A。

 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案【题目】由下列实验及现象,推出的相应结论正确的是
实验 | 现象 | 结论 |
A.用铂丝蘸取某金属的盐溶液, 在酒精灯火焰上灼烧 | 火焰呈黄色 | 此盐溶液中含有 Na+,不含 K+ |
B.向饱和NaHCO3溶液中加入足量氯水 | 有无色气体产生 | 氯水中含HClO |
C.将足量SO2气体通入石蕊试液中 | 石蕊试液变红色 | SO2水溶液显酸性 |
D.向酸性KMnO4溶液中通入SO2 | 溶液紫色褪去 | SO2具有漂白性 |
A.AB.BC.CD.D
【题目】H2O2是实验室常见的强氧化剂,在医疗上可用作消毒剂等。
(1)一种正在开发的利用O2和H2O作原料通过化合制取H2O2的方法,其原理如图所示。该方法制取H2O2的总化学反应方程式为____。
(2)为探究外界条件对H2O2分解化学反应速率的影响,相关实验设计如下表所示:
试管 编号 | 实验目的 | H2O2溶液 | 温度 | 水的 体积/mL | FeCl3溶液体积/mL | |
质量 分数 | 体积/mL | |||||
Ⅰ | 为编号Ⅱ实验参照 | 12% | 5.0 | 常温 | 0 | 0 |
Ⅱ | 温度对反应速率的影响 | ( ) | 5.0 | 60℃ | 0 | 0 |
Ⅲ | 为编号Ⅳ实验参照 | 4.0% | 5.0 | 常温 | ( ) | 0 |
Ⅳ | ( ) | 4.0% | 5.0 | 常温 | 0 | 1.0 |
填写表中缺少的内容:Ⅱ_______;Ⅲ__________;Ⅳ_________。
(3)由铂(Pt位于左边)和金(Au位于右边)组成的纳米棒放入H2O2溶液中(如图),纳米棒将发生定向移动。
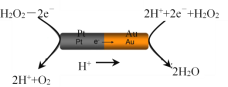
则:Au一侧为电池的____极(选填:“正”或“负”);纳米棒向____(选填:“左”或“右”)移动。