题目内容
【题目】常温下,电解质溶液中的下列关系式不正确的是( )
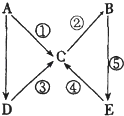
A.已知A?+H2B(过量) ![]() HA+HB? , 则结合H+的能力:HB?<A?<B2?
HA+HB? , 则结合H+的能力:HB?<A?<B2?
B.在0.1 mol?L?1的氨水中滴加0.1 mol?L?1盐酸,恰好完全中和时溶液的pH=a , 则由水电离产生的c(OH?)=10?a mol?L?1
C.将c mol?L?1的醋酸溶液与0.02 mol?L?1NaOH溶液等体积混合后溶液恰好呈中性,用含c的代数式表示CH3COOH的电离常数Ka= ![]()
D.将0.2 mol·L?1盐酸与0.1 mol·L?1的KAlO2溶液等体积混合,溶液中离子浓度由小到大的顺序:
c(Cl?)>c(K+)>c(Al3+)>c(H+)>c(OH?)
【答案】A
【解析】解:A、反应A+H2B(过量) ![]() HA+HB的实质是H2B提供一个H+给A- , 而H2B转化为HB- , 说明结合H+的能力: HB<A , 但从该反应不能判断结合H+的能力: A<B2 , A不正确; B.在0.1 molL1的氨水中滴加0.1 molL1盐酸,恰好完全中和时溶液的pH=a , 溶液的c(H+)=10a molL1均由水电离,因此水电离产生的c(OH)=c(H+)=10a molL1 , B正确;C .常温下溶液呈中性,则c(H+)=107molL1据电荷守恒c(CH3COO-)+c(OH-)= c(H+)+ c(Na+)得c(CH3COO-)=c(Na+)=0.01 molL1 , 根据物料守恒c(CH3COO-)+c(CH3COOH)=
HA+HB的实质是H2B提供一个H+给A- , 而H2B转化为HB- , 说明结合H+的能力: HB<A , 但从该反应不能判断结合H+的能力: A<B2 , A不正确; B.在0.1 molL1的氨水中滴加0.1 molL1盐酸,恰好完全中和时溶液的pH=a , 溶液的c(H+)=10a molL1均由水电离,因此水电离产生的c(OH)=c(H+)=10a molL1 , B正确;C .常温下溶液呈中性,则c(H+)=107molL1据电荷守恒c(CH3COO-)+c(OH-)= c(H+)+ c(Na+)得c(CH3COO-)=c(Na+)=0.01 molL1 , 根据物料守恒c(CH3COO-)+c(CH3COOH)= ![]() molL1得c(CH3COOH)=(
molL1得c(CH3COOH)=( ![]() -0.01)molL1 , 代入Ka的表达式得
-0.01)molL1 , 代入Ka的表达式得 ![]() ,C正确;D、将0.2 molL1盐酸与0.1 molL1的KAlO2溶液等体积混合,即HCl与KAlO2按物质的量之比2:1反应,化学方程式为3 KAlO2+6HCl = 3KCl +AlCl3 +2Al(OH)3↓,很明显c(Cl)>c(K+)>c(Al3+),再考虑Al3+水解使溶液显酸性,但水解程度小,可得出c(Al3+)>c(H+)>c(OH)
,C正确;D、将0.2 molL1盐酸与0.1 molL1的KAlO2溶液等体积混合,即HCl与KAlO2按物质的量之比2:1反应,化学方程式为3 KAlO2+6HCl = 3KCl +AlCl3 +2Al(OH)3↓,很明显c(Cl)>c(K+)>c(Al3+),再考虑Al3+水解使溶液显酸性,但水解程度小,可得出c(Al3+)>c(H+)>c(OH)
, 故c(Cl)>c(K+)>c(Al3+)>c(H+)>c(OH),D正确。
【考点精析】掌握弱电解质在水溶液中的电离平衡是解答本题的根本,需要知道当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理.