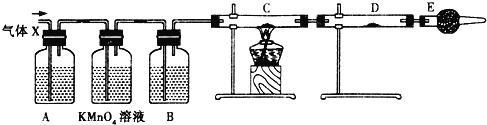
题目内容
【题目】硫化钠广泛应用于染料工业。请完成下列各题:
(1)![]() 的核外电子排布式_______________,其核外有_______种不同运动状态的电子。写出Na2O的电子式___________,比较Na2O和Na2S的熔点高低:Na2O______Na2S。
的核外电子排布式_______________,其核外有_______种不同运动状态的电子。写出Na2O的电子式___________,比较Na2O和Na2S的熔点高低:Na2O______Na2S。
(2)O、S属于同主族元素,其单质的氧化性不同,用一反应的化学方程式表示:_____________,O、S、![]() 半径从大到小的顺序是_________________。
半径从大到小的顺序是_________________。
II.1100℃时,在体积固定且为5L的密闭容器中,发生可逆反应: ![]() 并达到平衡。
并达到平衡。
(1)上述平衡的平衡常数表达式![]() _____________。欲使
_____________。欲使![]() 值变大,可采取的措施是__________________________。平衡后,向容器中充入1mol H2,平衡向__________(填“正反应方向”、“逆反应方向”或“不移动”),重新达到平衡后,与原平衡相比,逆反应速率______(填“增大”、“减小”或“不变”)。
值变大,可采取的措施是__________________________。平衡后,向容器中充入1mol H2,平衡向__________(填“正反应方向”、“逆反应方向”或“不移动”),重新达到平衡后,与原平衡相比,逆反应速率______(填“增大”、“减小”或“不变”)。
(2)若混合气体的密度不变,(填“能”或“不能”)_________判断该反应已经达到平衡状态。若初始时加入的Na2SO4为2.84g,10分钟后达到平衡时Na2SO4的转化率为45%, ![]() ________。
________。
【答案】 1S22S22P63S23P6 18 ![]() > 2H2S+O2→2S↓+2H2O S2->S>O
> 2H2S+O2→2S↓+2H2O S2->S>O  升高温度 正反应方向 增大 能 7.2×10-4mol/(L·min)
升高温度 正反应方向 增大 能 7.2×10-4mol/(L·min)
【解析】试题分析:(1)![]() 核外有18个电子;有几个电子就有几种运动状态;Na2O由钠离子和氧离子构成;离子半径越小晶格能越大,熔点越高;(2)同主族元素从上到下氧化性减弱,所以氧化性O2>S,可以通过氧化剂的氧化性大于氧化产物的氧化性证明;O原子2个电子层,S、
核外有18个电子;有几个电子就有几种运动状态;Na2O由钠离子和氧离子构成;离子半径越小晶格能越大,熔点越高;(2)同主族元素从上到下氧化性减弱,所以氧化性O2>S,可以通过氧化剂的氧化性大于氧化产物的氧化性证明;O原子2个电子层,S、![]() 都有3个电子层、16个质子,S原子的电子数16、
都有3个电子层、16个质子,S原子的电子数16、![]() 的电子数18;II. (1)固体不能写入平衡常数表达式;增大反应物浓度平衡正向移动;增大氢气浓度,重新达到平衡后
的电子数18;II. (1)固体不能写入平衡常数表达式;增大反应物浓度平衡正向移动;增大氢气浓度,重新达到平衡后![]() 的浓度增大;(2)根据方程式,反应过程中气体由氢气变为水蒸气,气体质量增大,容器体积不变,根据
的浓度增大;(2)根据方程式,反应过程中气体由氢气变为水蒸气,气体质量增大,容器体积不变,根据![]() ,反应过程中密度是变量;根据
,反应过程中密度是变量;根据![]() 计算反应速率。
计算反应速率。
解析:(1)![]() 核外有18个电子,根据能量最低原则,核外电子排布式是1S22S22P63S23P6;有几个电子就有几种运动状态,所以核外有18种不同运动状态的电子;Na2O由钠离子和氧离子构成,Na2O的电子式是
核外有18个电子,根据能量最低原则,核外电子排布式是1S22S22P63S23P6;有几个电子就有几种运动状态,所以核外有18种不同运动状态的电子;Na2O由钠离子和氧离子构成,Na2O的电子式是![]() ;离子半径越小晶格能越大,熔点越高,氧离子半径小于硫离子,所以熔点Na2O>Na2S;(2)同主族元素从上到下氧化性减弱,所以氧化性O2>S,根据氧化剂的氧化性大于氧化产物的氧化性,向硫化氢溶液中通入氧气生成浅黄色沉淀S可以证明氧化性O2>S,化学方程式是
;离子半径越小晶格能越大,熔点越高,氧离子半径小于硫离子,所以熔点Na2O>Na2S;(2)同主族元素从上到下氧化性减弱,所以氧化性O2>S,根据氧化剂的氧化性大于氧化产物的氧化性,向硫化氢溶液中通入氧气生成浅黄色沉淀S可以证明氧化性O2>S,化学方程式是![]() ;O原子2个电子层,S、
;O原子2个电子层,S、![]() 都有3个电子层、16个质子,S的电子数16、
都有3个电子层、16个质子,S的电子数16、![]() 的电子数18,所以O、S、
的电子数18,所以O、S、![]() 半径从大到小的顺序是S2->S>O;II. (1)固体不能写入平衡常数表达式,平衡常数表达式
半径从大到小的顺序是S2->S>O;II. (1)固体不能写入平衡常数表达式,平衡常数表达式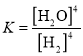 ;该反应吸热,升高温度平衡正向移动,平衡常数增大;增大反应物浓度平衡正向移动,所以平衡后,向容器中充入1mol H2,平衡向正反应方向移动;增大氢气浓度,重新达到平衡后
;该反应吸热,升高温度平衡正向移动,平衡常数增大;增大反应物浓度平衡正向移动,所以平衡后,向容器中充入1mol H2,平衡向正反应方向移动;增大氢气浓度,重新达到平衡后![]() 的浓度增大,所以逆反应速率增大;(2)根据方程式,反应过程中气体由氢气变为水蒸气,气体质量增大,容器体积不变,根据
的浓度增大,所以逆反应速率增大;(2)根据方程式,反应过程中气体由氢气变为水蒸气,气体质量增大,容器体积不变,根据![]() ,反应过程中密度是变量,所以若混合气体的密度不变,能说明反应达到平衡状态;2.84g Na2SO
,反应过程中密度是变量,所以若混合气体的密度不变,能说明反应达到平衡状态;2.84g Na2SO![]() =
=![]() 7.2×10-4mol/(L·min)。
7.2×10-4mol/(L·min)。

 备战中考寒假系列答案
备战中考寒假系列答案