题目内容
【题目】常见物质A~K之间存在如下图所示的转化关系,其中D、E为单质,请回答下列问题(图中有些反应的产物和反应的条件没有全部标出)。
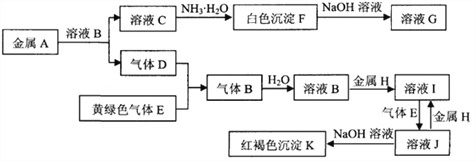
(1)写出下列物质中溶质的名称:B是 __________,G是____________
(2)反应“F→G”的化学方程式是_____________________________________________
(3)反应“J→I”的离子方程式是_____________________________________________
(4)溶液I中混有溶液J,除去J的方法是:___________________________
(5)检验溶液I中阳离子的方法是:__________________________
(6)向30 mL 1 mol·L-1的C溶液中逐渐加入浓度为4 mol·L-1的NaOH溶液,若产生0.78 g白色沉淀,则加入的NaOH溶液的体积可能为______________mL。
【答案】 氯化氢 偏铝酸钠 Al(OH)3+NaOH=NaAlO2+2H2O 2Fe3++Fe=3Fe2+ 加入足量的铁粉(过滤) 取少量溶液I于试管中,滴加几滴硫氰化钾溶液,溶液不变红色,再加几滴氯水,溶液变为红色,证明溶液中含有Fe2+。(其它方法,正确也给分) 7.5 和27.5
【解析】本题考查无机推断,黄绿色气体为Cl2,根据氯气的化学性质,即气体D为H2,气体B为HCl,红褐色沉淀K为Fe(OH)3,即金属H为Fe,溶液I为FeCl2,溶液J为FeCl3,溶液C加入NH3·H2O出现白色沉淀,白色沉淀F中加入NaOH溶液,沉淀溶解,因此白色沉淀F为Al(OH)3,即金属A为Al,(1)根据上述分析,气体B为氯化氢,F为偏铝酸钠;(2)F→G化学反应方程式为Al(OH)3+OH-=AlO2-+2H2O;(3)J→I的离子反应方程式2Fe3++Fe=3Fe2+;(4)除去混在Fe2+中的Fe3+,向溶液I中加入铁粉,然后过滤;(5)检验Fe2+的方法:取少量溶液I,滴加几滴KSCN溶液,溶液不变红,再加入氯气或H2O2,溶液变为红色,证明溶液中含有Fe2+;(7)C溶液为AlCl3,当加入NaOH溶液,只发生Al3++3OH-=Al(OH)3↓, 消耗NaOH的体积![]() L=0.0075L,合7.5mL,如果发生Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O,当AlCl3全部生成氢氧化铝沉淀,此时氢氧化铝的物质的量为30×10-3×1mol=0.03mol,此时氢氧化钠的物质的量为0.09mol,因为产生沉淀0.78g,说明有一部分氢氧化铝与NaOH发生反应,此时消耗NaOH的物质的量为(0.03-0.01)mol=0.02mol,因此氢氧化钠的体积=(0.09+0.02)/4L=0.0275L,合27.5mL。
L=0.0075L,合7.5mL,如果发生Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O,当AlCl3全部生成氢氧化铝沉淀,此时氢氧化铝的物质的量为30×10-3×1mol=0.03mol,此时氢氧化钠的物质的量为0.09mol,因为产生沉淀0.78g,说明有一部分氢氧化铝与NaOH发生反应,此时消耗NaOH的物质的量为(0.03-0.01)mol=0.02mol,因此氢氧化钠的体积=(0.09+0.02)/4L=0.0275L,合27.5mL。

 阅读快车系列答案
阅读快车系列答案【题目】某溶液中,若忽略水的电离,只含有下表中所示的四种离子,推测X离子及其个数b可能为
离子 | Na+ | Al3+ | Cl- | X |
个数 | 3a | 2a | a | b |
A.OH-、8aB.NO3-、4aC.SO42-、4aD.SO42-、8a
【题目】某温度下,在三个容积均为1L的恒容密闭容器中仅发生反应: 2NO(g)+Br2(g)![]() 2NOBr(g)(正反应放热)。下列说法正确的是
2NOBr(g)(正反应放热)。下列说法正确的是
容器 编号 | 物质的起始浓度(mol/L) | 物质的平衡浓度(mol/L) | ||
c(NO) | c(Br2) | c(NOBr) | c(NOBr) | |
I | 0.3 | 0.15 | 0.1 | 0.2 |
II | 0.4 | 0.2 | 0 | |
III | 0 | 0 | 0.2 | |
A. 容器II达平衡所需的时间为4min,则v(Br2)=0.05mol/(Lmin)
B. 达平衡时,容器I与容器III中的总压强之比为2:1
C. 升高温度,逆反应速率增大,正反应速率减小,平衡向逆反应方向移动
D. 达平衡时,容器II中c(Br2)/c(NOBr)比容器III中的小