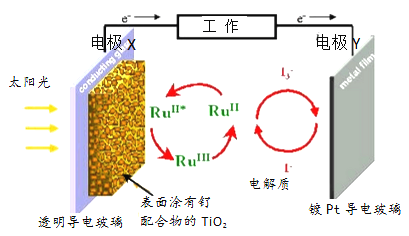
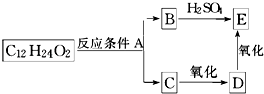
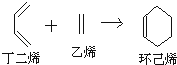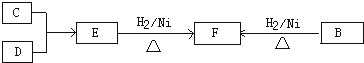题目内容
【题目】实验室制备三氯乙醛(CCl3CHO)的反应原理为C2H5OH+4Cl2→CCl3CHO+5HCl可能发生的副反应是C2H5OH+HCl→C2H5Cl+H2O。某探兖小组模拟制备三氯乙醛的实验装置如图所示(夹持、加热装置均略去)。回答下列问题:

(1)仪器a的名称是______________。
(2)装置A中发生反应的离子方程式为____________________________________。
(3)仪器b中冷凝水从______(填“p”或“q”,下同)口进,___________口出。
(4)若撤去装置B,对实验的影响是__________________________________________________。
(5)实验时发现D中导管口处气泡速率过快,合理的解决方法是______________________。
(6)已知:CCl3CHO+OH-→CHCl3+HCOO-;HCOO-+I2-=H++2I-+CO2↑;I2+2S2O32-=2I-+S4O62-。称取0.40g产品,配成待测溶液,加入20.00mL0.100mol·L-1碘标准溶液,再加入适量Na2CO3溶液,反应完全后,加盐酸调节溶液的pH,并立即用0.020mol·L-1的Na2S2O3溶液滴定至终点。重复上述操作3次,平均消耗Na2S2O3溶液20.00mL。滴定时所用指示剂是__________________________,达到滴定终点的现象是_____________________________________________________,测得产品的纯度为___________。
【答案】 (恒压)分液漏斗 MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O p q 会有氯化氢杂质与乙醇反应,生成氯乙烷。导致三氯乙醛的纯度降低 停止对A加热或控制滴加盐酸的量 淀粉溶液 蓝色变为无色,且半分钟内不变色 66.4%(或66.375%)
Mn2++Cl2↑+2H2O p q 会有氯化氢杂质与乙醇反应,生成氯乙烷。导致三氯乙醛的纯度降低 停止对A加热或控制滴加盐酸的量 淀粉溶液 蓝色变为无色,且半分钟内不变色 66.4%(或66.375%)
【解析】A装置利用二氧化锰与浓盐酸制备氯气,反应的方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,B装置用饱和食盐水除去HCl,C装置盛放浓硫酸干燥氯气,D中反应制备CCl3CHO,E装置盛放氢氧化钠溶液,吸收尾气中氯气、HCl防止污染空气。
MnCl2+Cl2↑+2H2O,B装置用饱和食盐水除去HCl,C装置盛放浓硫酸干燥氯气,D中反应制备CCl3CHO,E装置盛放氢氧化钠溶液,吸收尾气中氯气、HCl防止污染空气。
(1)由仪器a的结构可知,该分液漏斗能平衡压强,使漏斗内液体顺利滴下,为恒压分液漏斗,故答案为:恒压分液漏斗;
(2)装置A中浓盐酸与二氧化锰在加热时反应放出氯气,反应的离子方程式为MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O,故答案为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O,故答案为:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(3)冷凝管水流遵循下口进上口出,即p口进,q口出,故答案为:p;q;
(4)装置B中的饱和食盐水可以除去氯气中的杂质氯化氢,若撤去装置B,氯化氢杂质会与乙醇反应,生成氯乙烷,导致三氯乙醛的纯度降低,故答案为:会有氯化氢杂质与乙醇反应,生成氯乙烷,导致三氯乙醛的纯度降低;
(5)实验时发现D中导管口处气泡速率过快,可以停止对A加热或控制滴加盐酸的量,适当降低生成氯气的速率,故答案为:停止对A加热或控制滴加盐酸的量;
(6)根据CCl3CHO+OH-→CHCl3+HCOO-;HCOO-+I2-=H++2I-+CO2↑;I2+2S2O32-=2I-+S4O62-,反应过程中涉及碘单质,可以选用淀粉作指示剂;滴定终点的现象为蓝色变为无色,且半分钟内不变色;根据消耗的Na2S2O3计算剩余I2的物质的量0.02000molL-1×0.02L×![]() =2×10-4mol,与HCOO-反应的I2的物质的量为0.1000molL-1×0.02L-2×10-4mol=1.8×10-3mol,由CCl3CHO~HCOO-~I2可知,CCl3CHO的物质的量为1.8×10-3mol,则产品的纯度为
=2×10-4mol,与HCOO-反应的I2的物质的量为0.1000molL-1×0.02L-2×10-4mol=1.8×10-3mol,由CCl3CHO~HCOO-~I2可知,CCl3CHO的物质的量为1.8×10-3mol,则产品的纯度为![]() ×100%=66.4%,故答案为:淀粉溶液;蓝色变为无色,且半分钟内不变色;66.4%。
×100%=66.4%,故答案为:淀粉溶液;蓝色变为无色,且半分钟内不变色;66.4%。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案