题目内容
【题目】碳在空气中燃烧后所得4.48 L(标准状况)的混合气体,组成为CO、CO2、N2(其他成分忽略),平均相对分子质量为30,与足量的灼热氧化铜反应,所得的气体质量增加了0.4 g:
(1)N2的体积________。
(2)原空气中O2、N2的体积比为________。
【答案】3.36 L 1∶4
【解析】
(1)所得气体质量增加了0.4 g,是由反应CO+CuO![]() CO2+Cu所致,可利用差量法,求出CO的质量、体积或物质的量,然后利用平均相对分子质量为30,建立等量关系式,可求出CO2的体积,最后求出N2的体积。
CO2+Cu所致,可利用差量法,求出CO的质量、体积或物质的量,然后利用平均相对分子质量为30,建立等量关系式,可求出CO2的体积,最后求出N2的体积。
(2)利用氧元素守恒,可求出O2的体积,从而求出原空气中O2、N2的体积比。
(1)由反应式CO+CuO![]() CO2+Cu,可建立下列关系式:
CO2+Cu,可建立下列关系式:
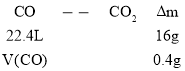
V(CO)=0.56 L。
M(CO)=28 g·mol-1,M(N2)=28 g·mol-1,M(CO2)=44 g·mol-1。
设混合气体中CO和N2的体积分数为x,则CO2的体积分数为1-x,
28x+44×(1-x)=30,x=![]() ,1-x=
,1-x=![]() ,V(CO2)=4.48×
,V(CO2)=4.48×![]() L=0.56 L
L=0.56 L
V(CO)=0.56 L,V(CO2)=0.56 L,V(N2)=4.48 L-(0.56+0.56)L=3.36 L。答案为:3.36 L;
(2)V(O2)=(0.56/2+0.56) L=0.84 L,V(O2) ∶V(N2)=0.84∶3.36=1∶4。答案为:1∶4。

【题目】为探究Fe(NO3)2等硝酸盐热分解产物和产物的性质,某化学小组开展如下探究:
(查阅资料)2KNO3![]() 2KNO2+O2↑ Fe(NO3)2
2KNO2+O2↑ Fe(NO3)2![]() FexOy+NO2↑+O2↑
FexOy+NO2↑+O2↑
实验一:探究Fe(NO3)2热分解固体产物中铁元素的价态。该小组甲同学将分解后的固体产物溶于足量的稀H2SO4得到相应两份溶液,进行以下探究实验。
(1)(提纯猜想)
猜想一:铁元素只显+2价;
猜想二:铁元素_____________;
猜想三:铁元素既有+2价又有+3价。
(实验操作)①向一份溶液中滴入KSCN溶液;向另一份溶液中滴入酸性KMnO4稀溶液。
(2)(实验现象)实验①_____________________;实验②____________________。
(3)(实验结论)猜想二成立,则Fe(NO3)2分解的化学方程式是_________________。
实验二:
(4)探究Fe(NO3)2热分解气体产物的性质。小组乙同学进行料如下实验,请完成实验空缺部分内容。限选试剂和用品:浓H2SO4溶液、4mol/LNaOH溶液、0.1mol/LBaCl2溶液、带火星的木条、0.1mol/L酸性KMnO4溶液、蒸馏水。
实验步骤 | 预期现象和结论 |
步骤1:取少量Fe(NO3)2固体于试管中,加热分解。 | ____________________________________,说明分解产生的气体中含有NO2。 |
步骤2:将产生的气体依次通过盛有足量_________________、浓硫酸的洗气瓶,______________________在最后一个出口检验。 | _____________________________________,说明分解产生的气体中含O2。 |
实验三:KNO3中混有Fe(NO3)2,为确定其中铁元素的含量,小组丙同学进行如下实验:①取混合物样品10g,充分加热分解;②将固体产物溶解、过滤,取沉淀进行洗涤、干燥,称得其质量为3.2g。则混合物中铁元素的质量分数为__________________。(保留三位有效数字,相对原子质量:Fe:56 O:16)
【题目】催化还原CO2是解决温室效应及能源问题的重要手段之一。研究表明,在Cu/ZnO催化剂存在下,在CO2中通入H2,二者可发生以下两个平行反应:
反应Ⅰ CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH1=-53.7 kJ·mol-1
CH3OH(g)+H2O(g) ΔH1=-53.7 kJ·mol-1
反应Ⅱ CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH2=+41.2 kJ·mol-1
CO(g)+H2O(g) ΔH2=+41.2 kJ·mol-1
(1)反应Ⅰ的化学平衡常数表达式是K=_______________________________。
(2)一定温度下,在容积可变的密闭容器中进行反应Ⅱ,不能确定上述可逆反应已达到化学平衡状态的是_____________
A.体系的体积不再发生变化 B.生成n mol CO的同时消耗n mol H2O
C.混合气的密度不再改变 D.1 mol H—H键断裂的同时断裂2 mol H—O键
(3)某实验室控制一定的CO2和H2初始投料比,在相同压强下,经过相同的反应时间测得如下实验数据(其中“甲醇选择性”是指转化的CO2中生成甲醇的百分比):
反应序号 | T/K | 催化剂 | CO2转化率/% | 甲醇选择性/% |
① | 543 | Cu/ZnO纳米棒 | 12.3 | 42.3 |
② | 543 | Cu/ZnO纳米片 | 10.9 | 72.7 |
③ | 553 | Cu/ZnO纳米棒 | 15.3 | 39.1 |
④ | 553 | Cu/ZnO纳米片 | 12.0 | 71.6 |
①对比表中①和③可发现:同样催化剂条件下,温度升高,CO2转化率升高, 而甲醇的选择性却降低,请解释甲醇选择性降低的可能原因________________________________;
②对比表中①、②可发现,在同样温度下,采用Cu/ZnO纳米片使CO2转化率降低, 而甲醇的选择性却提高,请解释甲醇的选择性提高的可能原因___________________________________________。
③有利于提高CO2转化为CH3OH平衡转化率的措施有____________。
a.使用Cu/ZnO纳米棒做催化剂 b.使用Cu/ZnO纳米片做催化剂
c.降低反应温度 d.投料比不变,增加反应物的浓度
e.增大CO2和H2的初始投料比
(4)反应混合气体经过降温加压可分离出甲醇,剩余气体可再次充入反应器继续反应,经过多次循环往复后混合气体中CO的含量已经很高,可以在另外容器中在合适的催化剂条件下使CO和H2反应合成CH3OH(g),写出该反应的热化学方程式:_______________________________。
【题目】根据下列实验操作和观察到的现象,得出的结论一定是正确的是( )
实验操作 | 现象 | 结论 | |
A |
| 溴水褪色 |
|
B | 将硫酸酸化的 | 溶液变成黄色 | 氧化性: |
C | 将溴乙烷与NaOH的乙醇溶液共热,将生成的气体直接通入 |
| 乙烯使 |
D | 向a、b两支盛有 | a试管中溶液变蓝 b试管中产生黄色沉淀 |
|
A.AB.BC.CD.D