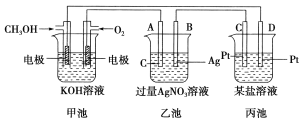
题目内容
【题目】为探究Fe(NO3)2等硝酸盐热分解产物和产物的性质,某化学小组开展如下探究:
(查阅资料)2KNO3![]() 2KNO2+O2↑ Fe(NO3)2
2KNO2+O2↑ Fe(NO3)2![]() FexOy+NO2↑+O2↑
FexOy+NO2↑+O2↑
实验一:探究Fe(NO3)2热分解固体产物中铁元素的价态。该小组甲同学将分解后的固体产物溶于足量的稀H2SO4得到相应两份溶液,进行以下探究实验。
(1)(提纯猜想)
猜想一:铁元素只显+2价;
猜想二:铁元素_____________;
猜想三:铁元素既有+2价又有+3价。
(实验操作)①向一份溶液中滴入KSCN溶液;向另一份溶液中滴入酸性KMnO4稀溶液。
(2)(实验现象)实验①_____________________;实验②____________________。
(3)(实验结论)猜想二成立,则Fe(NO3)2分解的化学方程式是_________________。
实验二:
(4)探究Fe(NO3)2热分解气体产物的性质。小组乙同学进行料如下实验,请完成实验空缺部分内容。限选试剂和用品:浓H2SO4溶液、4mol/LNaOH溶液、0.1mol/LBaCl2溶液、带火星的木条、0.1mol/L酸性KMnO4溶液、蒸馏水。
实验步骤 | 预期现象和结论 |
步骤1:取少量Fe(NO3)2固体于试管中,加热分解。 | ____________________________________,说明分解产生的气体中含有NO2。 |
步骤2:将产生的气体依次通过盛有足量_________________、浓硫酸的洗气瓶,______________________在最后一个出口检验。 | _____________________________________,说明分解产生的气体中含O2。 |
实验三:KNO3中混有Fe(NO3)2,为确定其中铁元素的含量,小组丙同学进行如下实验:①取混合物样品10g,充分加热分解;②将固体产物溶解、过滤,取沉淀进行洗涤、干燥,称得其质量为3.2g。则混合物中铁元素的质量分数为__________________。(保留三位有效数字,相对原子质量:Fe:56 O:16)
【答案】只显+3价 溶液出现血红色 溶液紫红色不褪色 4Fe(NO3)2![]() 2Fe2O3+8NO2↑+O2↑ 有红棕色气体产生 4mol/LNaOH溶液 用带火星的木条 带火星的木条复燃 22.4%
2Fe2O3+8NO2↑+O2↑ 有红棕色气体产生 4mol/LNaOH溶液 用带火星的木条 带火星的木条复燃 22.4%
【解析】
(1)根据两个已知的猜想推断,猜想二必为铁元素只显+3价;
(2)根据实验结论推断,Fe(NO3)2受热分解产生的固体产物只有Fe2O3,Fe2O3与足量稀硫酸反应生成Fe3+的溶液,则Fe3+遇KSCN溶液变红,不能使酸性高锰酸钾溶液褪色;
(3)设Fe2O3的系数为1,根据铁、氮、氧原子个数守恒配平,该反应为2Fe(NO3)2![]() Fe2O3+4NO2↑+1/2O2↑,系数加倍可得:4Fe(NO3)2
Fe2O3+4NO2↑+1/2O2↑,系数加倍可得:4Fe(NO3)2![]() 2Fe2O3+8NO2↑+O2↑;
2Fe2O3+8NO2↑+O2↑;
(4)Fe(NO3)2受热分解产生的气体产物中,NO2是红棕色气体,O2是无色无味气体,有红棕色气体产生,就能说明分解产生的气体中含有NO2;由于NO2有毒,且易与水反应产生能与O2反应的NO,因此步骤2中应该先用过量4mol/LNaOH溶液吸收多余的NO2,再用浓硫酸干燥,在最后一个出气口用带火星的木条检验,若带火星木条复燃,说明分解产生的气体中含有O2;
实验三:根据题意可知,产物中m(Fe2O3)=3.2g;根据铁元素守恒可得关系式,2Fe→Fe2O3,则原料中m(Fe)= m(Fe2O3)×2×56/160=3.2g×2×56/160;由于混合物总质量为10g,则其中有铁元素的质量分数为3.2g×2×56/160÷10g×100%=22.4%。

 寒假学与练系列答案
寒假学与练系列答案