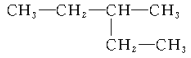��Ŀ����
����Ŀ��Ϊ�˲ⶨij�л���A�Ľṹ��������ʵ�飺
�ٽ�2.3g���л�����ȫȼ�գ�����0.1molCO2��2.7gˮ��
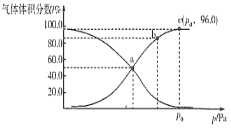
���������Dzⶨ����Է�������������ͼһ��ʾ������ͼ��
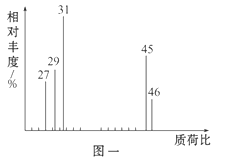
���ú˴Ź����Ǵ����û�����õ���ͼ����ʾͼ�ף�ͼ������������֮����1��2��3��
�Իش��������⣺
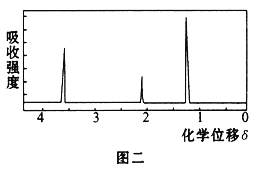
��1���л���A����Է���������___��
��2���л���A��ʵ��ʽ��__��
��3���ܷ����A��ʵ��ʽȷ��A�ķ���ʽ__(������������������)�����ܣ���A�ķ���ʽ��__�������ܣ���˿ղ��
��4��д���л���A���ܵĽṹ��ʽ___��
���𰸡�46 C2H6O �� C2H6O CH3CH2OH
��������
(1)��A������ͼ�У�����ʺɱ�Ϊ46������A����Է�������Ϊ46��
(2)��2.3g���л�����ȫȼ�գ�����0.1molCO2��2.7gˮ�����������غ㶨�ɿ�֪��n(C)=n(CO2)=0.1mol��m(C)=0.1mol��12gmol-1=1.2g��n(H)=![]() ��2=0.3mol��m(H)=0.3mol��1gmol-1=0.3g�����л�������к���C��HԪ�ص�������Ϊ��1.2g+0.3g=1.5g��˵���������һ��������Ԫ�أ�������Ԫ������Ϊ��m(O)=2.3g-1.2g-0.3g=0.8g����n(O)=
��2=0.3mol��m(H)=0.3mol��1gmol-1=0.3g�����л�������к���C��HԪ�ص�������Ϊ��1.2g+0.3g=1.5g��˵���������һ��������Ԫ�أ�������Ԫ������Ϊ��m(O)=2.3g-1.2g-0.3g=0.8g����n(O)=![]() =0.05mol������n(C)��n(H)��n(O)=0.1mol��0.3mol��0.05mol=2��6��1��A��ʵ��ʽ��C2H6O��
=0.05mol������n(C)��n(H)��n(O)=0.1mol��0.3mol��0.05mol=2��6��1��A��ʵ��ʽ��C2H6O��
(3)��֪���л����ʵ��ʽC2H6O������Է���������46�����Կ���ȷ������A�ķ���ʽΪC2H6O��
(4)��A�ĺ˴Ź�������֪A����3����ԭ�ӣ�������Ϊ1��2��3������A�Ľṹ��ʽΪ��CH3CH2OH��

 �����ҵ���������ͯ������ϵ�д�
�����ҵ���������ͯ������ϵ�д�