题目内容
【题目】绿水青山就是金山银山,生产生活中污染物的合理处理对环境保护具有重要意义。
(1)利用某些催化剂,成功实现将空气中的碳氧化合物和氮氧化合物转化为无毒的大气循环物质。
已知:① 2NO(g)+O2(g)![]() 2NO2(g)△H3=﹣112.0kJmol﹣1
2NO2(g)△H3=﹣112.0kJmol﹣1
② NO(g)+CO(g)![]()
![]() N2(g)+CO2(g)△H2=﹣379.9kJmol﹣1
N2(g)+CO2(g)△H2=﹣379.9kJmol﹣1
③ N2(g)+O2(g)![]() 2NO(g)△H1=+179.8kJmol﹣1
2NO(g)△H1=+179.8kJmol﹣1
则反应NO(g)+CO2(g)![]() NO2(g)+CO(g)的△H=_____kJmol﹣1;某温度下,反应①②③的平衡常数分別为K1、K2、K3,则该反应的K= ____(用K1、K2、K3表示)。
NO2(g)+CO(g)的△H=_____kJmol﹣1;某温度下,反应①②③的平衡常数分別为K1、K2、K3,则该反应的K= ____(用K1、K2、K3表示)。
(2)一定温度下,向某密闭容器中充入1 mol NO2,发生反应:2NO2(g) ![]() N2O4(g),测得反应体系中气体体积分数与压强之间的关系如图所示:
N2O4(g),测得反应体系中气体体积分数与压强之间的关系如图所示:
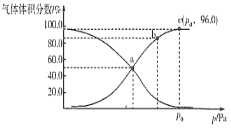
①a、b、c三点逆反应速率由大到小的顺序为___________。平衡时若保持压强、温度不变,再向体系中加入一定量的Ne,则平衡___________移动(填“正向”“逆向”或“不”)。
②a点时NO2的转化率为___________,用平衡分压代替平衡浓度也可求出平衡常数Kp,则该温度下Kp=___________Pa-1。
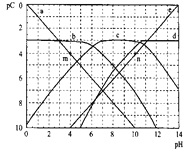
(3) 常温下,分别取未知浓度的HA和MOH溶液,加水稀释至原来体积的n倍。稀释过程中,两溶液的pH变化如图所示。
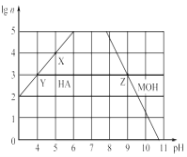
①HA为______酸,MOH为 ________碱(填“强”或“弱”);
②X、Y、Z三点水的电离程度关系是:________________ 。
【答案】+234.0 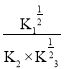 c>b>a 逆向 66.7%
c>b>a 逆向 66.7% ![]() HA为强酸 MOH为弱碱 X=Z>Y
HA为强酸 MOH为弱碱 X=Z>Y
【解析】
(1)根据盖斯定律求解;
(2) ①温度未变,a、b、c三点的c(N2O4)逐渐增大;根据勒夏特列原理判断;
②根据图像及三段式求解;
(3)①根据图像,溶液稀释10倍时,溶液的pH变化1为强电解质;
②X、Y、Z三点溶液的pH分别为5、4、9,则水电离产生的氢离子浓度分别为10-9mol/L、10-10mol/L、10-9mol/L。
(1)根据盖斯定律可知,![]() ×①-②-
×①-②-![]() ×③可得NO(g)+CO2(g) NO2(g)+CO(g)△H=-56.0 kJmol﹣1+379.9kJmol﹣1-89.9 kJmol﹣1=+234.0 kJmol﹣1;同理K=
×③可得NO(g)+CO2(g) NO2(g)+CO(g)△H=-56.0 kJmol﹣1+379.9kJmol﹣1-89.9 kJmol﹣1=+234.0 kJmol﹣1;同理K=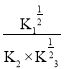 ;
;
(2) ①温度未变,a、b、c三点的c(N2O4)逐渐增大,则逆反应速率逐渐增大,则逆反应速率由大到小的顺序为c>b>a;若保持压强、温度不变,再向体系中加入一定量的Ne,容器的容积增大,平衡向物质的量增大的方向移动,即逆反应方向移动;
②根据图像可知,NO2(g) 、N2O4(g)的体积分数相等,根据三段式
2NO2(g) ![]() N2O4(g)
N2O4(g)
初始:1 0
反应:x 0.5x
平衡:1-x 0.5x
体积分数相等,即1-x=0.5x,则x=![]() ,转化率=
,转化率=![]() ×100%=66.7%;
×100%=66.7%;
根据图像可知,平衡时,P(N2O4)=P0×96%,P(NO2)=P0×4%,Kp= ![]() =
=![]() ;
;
(3)①HA由Y点到X点,溶液稀释10倍,溶液的pH增大1,说明HA完全电离,为强酸;MOH稀释10倍时,溶液的pH减小值小于1,则MOH为弱碱;
②X、Y、Z三点溶液的pH分别为5、4、9,则水电离产生的氢离子浓度分别为10-9mol/L、10-10mol/L、10-9mol/L,水的电离程度的关系为X=Z>Y。