题目内容
【题目】某工厂用 FeCl3 溶液腐蚀镀有铜的绝缘板生产印刷电路。课外活动小组为确认生产后的废液的组成,进行如下实验:(1)取10mL 废液加入足量的 AgNO3 溶液,生成沉淀 8.61g。(2)另取 10mL废液放入铜片充分反应,铜片质量减少了0.256g。下列关于原废液组成的判断错误的是
A. 一定含有 Fe 2+、 Fe 3+、 Cu2+、 Clˉ B. c(Fe2+):c(Cu2+) = 2:1
C. c(Clˉ) = 6mol / L, c(Fe 2+) = 1.2mol / L D. c (Fe2+):c(Fe 3+) = 3:1
【答案】D
【解析】
A.废液放入铜片充分反应,铜片质量减少了0.256g,说明溶液中含有Fe3+,结合反应2FeCl3+Cu═2FeCl2+CuCl2可知,原废液一定含有Fe2+、Fe3+、Cu2+、Cl-,故A正确;B.由方程式2FeCl3+Cu═2FeCl2+CuCl2可知,原废液中c(Fe2+)=2c(Cu2+),c(Fe2+):c(Cu2+)=2∶1,故B正确;C.由D中分析可知,c(Cl-)=6mol/L,c(Fe2+)=1.2 mol/L,故C正确;D.废液加入足量的AgNO3溶液,生成沉淀0.06 mol,沉淀为AgCl,原废液中c(Cl-)=![]() =6 mol/L,废液放入铜片充分反应,铜片质量减少了0.256 g,物质的量为
=6 mol/L,废液放入铜片充分反应,铜片质量减少了0.256 g,物质的量为![]() =0.004 mol,10mL废液中Fe3+为nmol,则:
=0.004 mol,10mL废液中Fe3+为nmol,则:
2FeCl3+Cu═2FeCl2+CuCl2
2 1
nmol0.004mol
故n=0.008 mol,所以原废液中c(Fe3+)=![]() =0.8 mol/L,
=0.8 mol/L,
由方程式2FeCl3+Cu═2FeCl2+CuCl2可知,原废液中c(Fe2+)=2c(Cu2+),根据电荷守恒,原废液中3c(Fe3+)+2c(Fe2+)+2c(Cu2+)=c(Cl-),故3×0.8+2c(Fe2+)+c(Fe2+)=6,解得c(Fe2+)=1.2 mol/L,故原废液中c(Fe2+)∶c(Fe3+)=1.2 mol/L∶0.08 mol/L=3:2,故D错误;故选D。

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案【题目】向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)![]() 2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示:
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示:
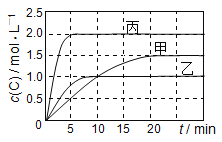
容器 | 甲 | 乙 | 丙 |
容积 | 0.5 L | 0.5 L | 1.0 L |
温度/℃ | T1 | T2 | T2 |
反应物 起始量 | 1.5 mol A 0.5 mol B | 1.5 mol A 0.5 mol B | 6.0 mol A 2.0 mol B |
下列说法正确的是( )
A.平衡后,向甲容器中再充入0.5 mol A,A和B的转化率均增大
B.达到平衡时反应吸收的热量:Q丙> 2Q乙
C.若平衡时保持温度不变,改变容器体积平衡不移动
D.T1℃,起始时甲容器中充入0.5 mol A、1.5 mol B,平衡时A的转化率为25%


