题目内容
7.下表是元素周期表的一部分,请回答有关问题:主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 ;
;(2)表中能形成两性氢氧化物的元素是Al (用元素符号表示),写出该元素的单质与⑨最高价氧化物的水化物反应的离子方程式为2Al+2OH-+2H2O═2AlO2-+3H2↑;
(3)②、⑥、⑦三种元素的最高价氧化物的水化物中酸性最强的是HClO4(填化学式);
(4)⑨与④两种元素的最高价氧化物的水化物碱性较强的是KOH(填化学式);
(5)①的单质与②最高价氧化物的水化物浓溶液反应的化学方程式是C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$4NO2↑+CO2↑+2H2O;当消耗4.8g①的单质时,转移电子数为1.6NA.
分析 根据元素周期表知,①、②、③、④、⑤、⑥、⑦、⑧、⑨、⑩分别是C、N、F、Mg、Al、S、Cl、Ar、K、Br,
(1)最不活泼的元素是稀有气体元素;
(2)能形成两性氧化物的元素是铝,铝和强碱溶液能生成偏铝酸盐;
(3)元素的非金属性越强,其最高价氧化物的水化物酸性越强;
(4)元素的金属性越强,其最高价氧化物的水化物碱性越强;
(5)碳与与浓硝酸反应生成二氧化碳和二氧化碳,根据反应中的电子转移数目进行计算.
解答 解:根据元素周期表知,①、②、③、④、⑤、⑥、⑦、⑧、⑨、⑩分别是C、N、F、Mg、Al、S、Cl、Ar、K、Br,
(1)最不活泼的元素是稀有气体元素Ar,其原子结构示意图为: ,故答案为:
,故答案为: ;
;
(2)能形成两性氧化物的元素是铝,钾的最高价氧化物的水化物是氢氧化钾,氢氧化钾是强碱,铝和氢氧化钾溶液反应生成偏铝酸钾和氢气,反应的离子方程式为:2Al+2OH-+2H2O═2AlO2-+3H2↑,
故答案为:Al;2Al+2OH-+2H2O═2AlO2-+3H2↑;
(3)元素的非金属性越强,其最高价氧化物的水化物酸性越强,②、⑥、⑦三种元素中非金属性最强的是Cl元素,所以Cl的最高价氧化物的水化物中酸性最强,其化学式为HClO4,
故答案为:HClO4;
(4)元素的金属性越强,其最高价氧化物的水化物碱性越强,钾的金属性强于镁,所以氢氧化镁和氢氧化钾中碱性较强的是KOH,
故答案为:KOH;
(5)碳与与浓硝酸反应的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$4NO2↑+CO2↑+2H2O,根据方程式可知每消耗12g碳时,转移4mol电子,所以当消耗4.8g即0.4mol碳的单质时,转移电子数为1.6NA,
故答案为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$4NO2↑+CO2↑+2H2O;1.6NA.
点评 本题考查了元素周期表的应用,明确元素在周期表中的位置是解本题关键,会运用元素周期律解答该题,难度不大.

| A. | KNO3(NaCl)--结晶 | B. | 水(酒精)--分液 | ||
| C. | Cu(Fe)--溶于足量盐酸,过滤 | D. | CO2(HCl)--饱和碳酸氢钠溶液,洗气 |
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
| A. | 同温度、同体积、同压强的O2与N2 | B. | 同质量、不同密度的N2和C2H4 | ||
| C. | 同体积、同密度的CO和 CH4 | D. | 同压强、同体积的N2和O2 |
| A. |  | B. |  | C. |  | D. |  |
| A. | N2O4的消耗速率与NO2的生成速率之比为1:2 | |
| B. | 烧瓶内气体的颜色不再加深 | |
| C. | 烧瓶内气体的平均相对分子质量不再变化 | |
| D. | 烧瓶内气体的压强不再变化 |
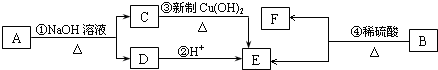
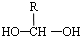 $\stackrel{-H_{2}O}{→}$
$\stackrel{-H_{2}O}{→}$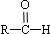 (R代表烃基).
(R代表烃基).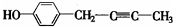 、
、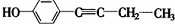 .
.
 (写结构简式)
(写结构简式) .
.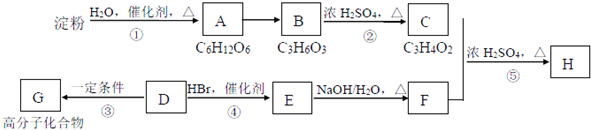
 ;反应类型:加聚反应.反应④的化学方程式:CH3CH=CH2+HBr$\stackrel{催化剂}{→}$CH3CHBrCH3;反应类型:加成反应.
;反应类型:加聚反应.反应④的化学方程式:CH3CH=CH2+HBr$\stackrel{催化剂}{→}$CH3CHBrCH3;反应类型:加成反应.