题目内容
【题目】298K时,在容积不变的密闭容器中注满NO2气体,2NO2(g)N2O4(g)△H<0.平衡后把该容器置于沸水中,下列性质或数值不会改变的是( )
①颜色 ②平均摩尔质量 ③质量 ④压强 ⑤密度.
A.①② B.②③ C.④⑤ D.③⑤
【答案】D
【解析】
试题2NO2(g)N2O4(g)△H<0,为放热反应,所以置于沸水中,温度升高,平衡向逆反应方向移动,①因为NO2为红棕色,N2O4无色,所以颜色变深;②气体质量不变,物质的量增大,所以平均摩尔质量减小,③根据质量守恒定律,质量不变,④平衡向逆反应方向移动,气体物质的量增大,压强增大,⑤气体质量不变,密闭容器的容积不变,故气体密度不变,所以答案为D。

 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案【题目】氯苯是燃料、医药、有机合成的中间体,是重要的有机化工产品。实验室制取氯苯的装置如图所示(加热和固定仪器的装置略去)。回答下列问题:
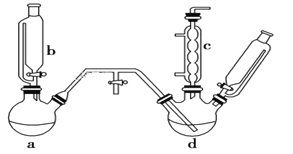
(1)a和b仪器组合成制取氯气的装置,反应无需加热,则a装置中的固体反应物可以是________(填字母序号)。
A.MnO2 B.KMnO4 C.K2Cr2O7
(2)把氯气通入反应器d中(d装置有FeCl3和苯),加热维持反应温度40~60 ℃,温度过高会生成过多的二氯苯。对d加热的方法是______________________。
(3)装置c出口的气体成分有HCl、Cl2、水蒸气和_____。
(4)制取氯苯的化学方程式为_______________________ 。
(5)装置d中的反应完成后,工业上要进行水洗、碱洗及食盐干燥,才能蒸馏。
①碱洗之前要水洗,其目的是______________________________。
②用10%NaOH溶液碱洗时发生氧化还原反应的化学反应方程式为_____________________。
(6)生成的氯气中存在HCl、H2O等杂质气体,若需要增加一个装置除去水蒸气,请画出该装置图,并标明所用试剂________。
(7)工业生产中苯的流失情况如下表所示:
项目 | 二氯苯 | 氯化尾气 | 蒸气 | 成品 | 不确定苯耗 | 合计 |
苯流失量kg/t | 11.7 | 5.4 | 20.8 | 2.0 | 49.3 | 89.2 |
则10t苯可制得成品氯苯________t(列出计算式即可。氯苯和苯的相对分子质量分别是112.5和78)。
【题目】如图的锥形瓶内充满干燥气体X,滴管内盛有液体Y,将滴管内的液体挤压到锥形瓶中,轻轻振荡,一会儿可见小气球a鼓涨,下列X和Y的组合不可能的是( )
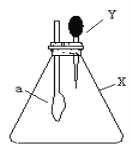
X | Y | |
A | HCl | 饱和食盐水 |
B | H2 | 浓硫酸 |
C | HCl | 2mol/L NaOH溶液 |
D | Cl2 | 6mol/L NaOH 溶液 |
A. A B. B C. C D. D
【题目】含氮化合物在工农业生产中都有重要应用。
(1)氮和肼(N2H4)是两种最常见的氮氢化物。
已知:4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) ΔH1=-541.8 kJ·mol-1,化学平衡常数为K1。N2H4(g)+O2(g)
2N2(g)+6H2O(g) ΔH1=-541.8 kJ·mol-1,化学平衡常数为K1。N2H4(g)+O2(g)![]() N2(g)+2H2O(g) ΔH2=-534 kJ·mol-1,化学平衡常数为K2。则用NH3和O2制取N2H4的热化学方程式为__________________,该反应的化学平衡常数K=________(用K1、K2表示)。
N2(g)+2H2O(g) ΔH2=-534 kJ·mol-1,化学平衡常数为K2。则用NH3和O2制取N2H4的热化学方程式为__________________,该反应的化学平衡常数K=________(用K1、K2表示)。
(2)对于2NO(g)+2CO(g)![]() N2(g)+2CO2(g),在一定温度下,于1 L的恒容密闭容器中充入0.1 mol NO和0.3 mol CO,反应开始进行。
N2(g)+2CO2(g),在一定温度下,于1 L的恒容密闭容器中充入0.1 mol NO和0.3 mol CO,反应开始进行。
①下列能说明该反应已经达到平衡状态的是______(填字母代号)。
A.c(CO)=c(CO2)
B.容器中混合气体的密度不变
C.v(N2)正=2v(NO)逆
D.容器中混合气体的平均摩尔质量不变
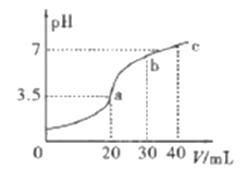
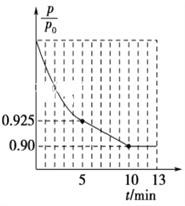
②图1为容器内的压强(p)与起始压强(p0)的比值![]() 随时间(t)的变化曲线。0~5min内,该反应的平均反应速率v(N2)=________,平衡时NO的转化率为________。
随时间(t)的变化曲线。0~5min内,该反应的平均反应速率v(N2)=________,平衡时NO的转化率为________。
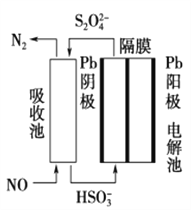
(3)使用间接电化学法可处理燃烧烟气中的NO,装置如图所示。已知电解池的阴极室中溶液的pH在4~7之间,写出阴极的电极反应式:____________________。用离子方程式表示吸收池中除去NO的原理____________________________________________。
【答案】 4NH3(g)+O2(g)2N2H4(g)+2H2O(g)ΔH=+526.2 kJ·mol-1 K1/K22 D 0.006 mol·L-1·min-1 80% 2HSO3-+2e-+2H+===S2O42-+2H2O 2NO+2S2O42-+2H2O===N2+4HSO3-
【解析】(1)①4NH3(g)+3O2(g) ![]() 2N2(g)+6H2O(g) ΔH1=-541.8kJ/mol,化学平衡常数为K1。②N2H4(g)+O2(g)
2N2(g)+6H2O(g) ΔH1=-541.8kJ/mol,化学平衡常数为K1。②N2H4(g)+O2(g) ![]() N2(g)+2H2O(g) ΔH2=-534kJ/mol,化学平衡常数为K2。根据盖斯定律,将①-②×2得:4NH3(g)+O2(g) = 2N2H4(g)+2H2O(g) ΔH=(-541.8kJ/mol)-(-534kJ/mol)×2=+526.2kJ/mol,该反应的化学平衡常数K=
N2(g)+2H2O(g) ΔH2=-534kJ/mol,化学平衡常数为K2。根据盖斯定律,将①-②×2得:4NH3(g)+O2(g) = 2N2H4(g)+2H2O(g) ΔH=(-541.8kJ/mol)-(-534kJ/mol)×2=+526.2kJ/mol,该反应的化学平衡常数K=![]() ,故答案为:4NH3(g)+O2(g) = 2N2H4(g)+2H2O(g) ΔH=+526.2kJ/mol;
,故答案为:4NH3(g)+O2(g) = 2N2H4(g)+2H2O(g) ΔH=+526.2kJ/mol; ![]() ;
;
(2)对于2NO(g)+2CO(g) ![]() N2(g)+2CO2(g),在一定温度下,于1L的恒容密闭容器中充入0.1molNO和0.3molCO,反应开始进行。
N2(g)+2CO2(g),在一定温度下,于1L的恒容密闭容器中充入0.1molNO和0.3molCO,反应开始进行。
①A.c(CO)=c(CO2),不表示浓度变化,不能判断是否为平衡状态,故A错误;B.反应中气体的质量不变,体积不变,容器中混合气体的密度始终不变,不能判断是否为平衡状态,故B错误;C.v(N2)正=2v(NO)逆表示,应该是2v(N2)正=v(NO)逆,才表示正逆反应速率相等,故C错误;D.该反应属于气体的物质的量发生变化的反应,容器中混合气体的平均摩尔质量不变时表示气体的物质的量不变, 说明是平衡状态,故D正确;故选D;
②根据容器内的压强(P)与起始压强(P0)的比值(P/P0)随时间(t)的变化曲线,0~5min内,![]() =0.925,根据阿伏伽德罗定律及其推论,
=0.925,根据阿伏伽德罗定律及其推论,![]() =0.925,平衡时
=0.925,平衡时![]() =0.90,
=0.90,
2NO(g)+ 2CO(g) ![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
起始(mol) 0.1 0.3 0 0
反应 2x 2x x 2x
5min及平衡 0.1-2x 0.3-2x x 2x
5min时,![]() =0.925,解得x=0.03mol,v(N2)=
=0.925,解得x=0.03mol,v(N2)=![]() = 0.006mol·L-1·min-1;平衡时,
= 0.006mol·L-1·min-1;平衡时,![]() =0.90,解得x=0.04mol,NO的转化率=
=0.90,解得x=0.04mol,NO的转化率=![]() ×100%=80%,故答案为:0.006 mol·L-1·min-1;80%;
×100%=80%,故答案为:0.006 mol·L-1·min-1;80%;
(3)阴极发生还原反应,是亚硫酸氢根离子,得电子,生成硫代硫酸根离子,电极反应式为:2HSO3-+2e-+2H+═S2O42-+2H2O;硫代硫酸根离子与一氧化氮发生氧化还原反应,生成氮气,离子反应方程式为:2NO+2S2O42-+2H2O═N2+4HSO3-;故答案为:2HSO3-+2H++2e-=S2O42-+2H2O;2NO+2S2O42-+2H2O=N2+4HSO3-。
【题型】填空题
【结束】
10
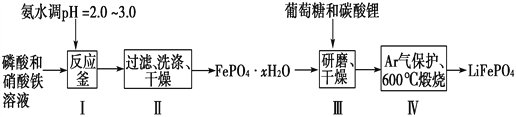
【题目】锂离子电池是目前具有最高比能量的二次电池。LiFePO4可极大地改善电池体系的安全性能,且具有资源丰富、循环寿命长、环境友好等特点,是锂离子电池正极材料的理想选择。生产LiFePO4的一种工艺流程如图:
已知:Ksp(FePO4·xH2O)=1.0×10-15,Ksp[Fe(OH)3]=4.0×10-38。
(1)在合成磷酸铁时,步骤Ⅰ中pH的控制是关键。如果pH<1.9,Fe3+沉淀不完全,影响产量;如果pH>3.0,则可能存在的问题是________________。
(2)步骤Ⅱ中,洗涤是为了除去FePO4·xH2O表面附着的________等离子。
(3)取3组FePO4·xH2O样品,经过高温充分煅烧测其结晶水含量,实验数据如下表:
实验序号 | 1 | 2 | 3 |
固体失重质量分数 | 19.9% | 20.1% | 20.0% |
固体失重质量分数=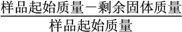 ×100%,则x=_______(精确至0.1)。
×100%,则x=_______(精确至0.1)。
(4)步骤Ⅲ中研磨的作用是__________________________________。
(5)在步骤Ⅳ中生成了LiFePO4、CO2和H2O,则氧化剂与还原剂的物质的量之比为________。
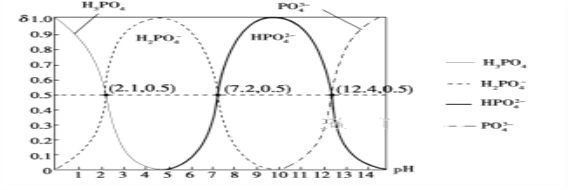
(6)H3PO4是三元酸,如图是常温下溶液中含磷微粒的物质的量分数(δ)随pH变化示意图。则PO![]() 第一步水解的水解常数K1的表达式为______,K1的数值最接近______(填字母)。
第一步水解的水解常数K1的表达式为______,K1的数值最接近______(填字母)。
A.10-12.4 B.10-1.6 C.10-7.2 D.10-4.2
【题目】请按要求回答下列问题:
I.25℃时,物质的量浓度均为0.1mol/L的几种盐溶液的pH如表:
序号 | ① | ② | ③ | ④ |
溶液 | NH4Cl | CH3COONH4 | NaHCO3 | Na2CO3 |
pH | 5 | 7 | 8.4 | 11.6 |
(1)用离子方程式解释溶液④能去除油污的原因________________________。
(2)写出溶液③中电荷守恒的关系式:_________________________________________。
(3)25℃时,溶液①中,由水电离产生的c(OH-)=_______mol/L;
根据溶液②,Ka(CH3COOH )_____Kb(NH3·H2O) (填“>”、“<”或“=”)。
II.根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2) 表面与水发生下列反应,
(1)已知: N2(g) + 3H2(g)![]() 2NH3(g) △H=-92.4kJ·mol-1
2NH3(g) △H=-92.4kJ·mol-1
2H2(g) + O2(g)= 2H2O (1) △H =-571.6kJ·mol-1
则2N2(g) + 6H2O(1)![]() 4NH3(g) + 3O2(g) △H=______。
4NH3(g) + 3O2(g) △H=______。
(2)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得: 3SiO2(s)+ 6C(s) + 2N2(g) ![]() Si3N4(s)+ 6CO(g)。该反应的平衡常数表达式为K=_________。
Si3N4(s)+ 6CO(g)。该反应的平衡常数表达式为K=_________。
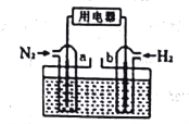
(3)以N2和H2为反应物(如下图),盐酸酸化的NH4Cl溶液为电解质的原电池,a电极的电极反应式为:____________________________________________。