题目内容
【题目】1、以物质的量为中心的计算:
(1)VL Al2(SO4)3溶液中含有Al3+m g,则SO42-的物质的量浓度为____________。
(2)3.01×1023个CO2在标准状况下的体积约为______L,它与_____g CO含有相同的氧原子数。
(3)在标准状况下22.4 L由氮气和氧气组成的混合气体,其质量为30g,则其中氧气的质量为________g。
2、将Cu投入足量的FeCl3的水溶液中,两者发生反应的化学方程式如下:2FeCl3+Cu=2FeCl2+CuCl2。
(1)请用双线桥法标出电子转移的方向和数目______________________。
(2)该反应中氧化剂是_______________,发生氧化反应的物质是_______________。
(3)当有0.4 mol电子发生转移时,发生反应的Cu的质量为____________。
(4)当有1 mol FeCl3完全反应时,转移的电子数目为____________。
【答案】m/18V mol·L-1 11.2 28 16 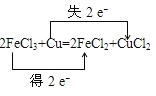 FeCl3 Cu 12.8g NA
FeCl3 Cu 12.8g NA
【解析】
1、根据n=m/M、n=V/Vm、N=nNA、c=n/V分析计算;
2、(1)化合价升高元素失电子,化合价降低元素得到电子,化合价升高数=化合价降低数=转移电子数;
(2)化合价降低元素所在的反应物是氧化剂,化合价升高元素所在的反应物是还原剂,发生氧化反应;
(3)根据方程式和转移电子的量来计算;
(4)根据方程式来计算。
1、(1)V LAl2(SO4)3溶液中含有Al3+m g,铝离子的物质的量是![]() ,根据化学式可知硫酸根离子的物质的量是
,根据化学式可知硫酸根离子的物质的量是![]() ,则SO42-的物质的量浓度为
,则SO42-的物质的量浓度为![]() 。
。
(2)3.01×1023个CO2的物质的量是![]() =0.5mol,在标准状况下的体积约为0.5mol×22.4L/mol=11.2L。含有1mol氧原子,则相应CO的物质的量是1mol,即它与28gCO含有相同的氧原子数。
=0.5mol,在标准状况下的体积约为0.5mol×22.4L/mol=11.2L。含有1mol氧原子,则相应CO的物质的量是1mol,即它与28gCO含有相同的氧原子数。
(3)在标准状况下22.4 L由氮气和氧气组成的混合气体的物质的量是1mol,设氮气和氧气的物质的量分别是xmol、ymol,则x+y=1、28x+32y=30,解得x=y=0.5,则其中氧气的质量为16g。
2、(1)化合价升高元素是Cu,失电子,化合价降低元素是Fe,得到电子,化合价升高数=化合价降低数=转移电子数=2,其电子转移的方向和数目可表示为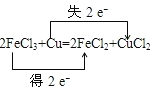 ;
;
(2)化合价降低元素Fe元素所在的反应物FeCl3是氧化剂,化合价升高元素Cu所在的反应物是还原剂,发生氧化反应的物质是Cu;
(3)根据方程式当有2mol电子发生转移时,发生反应的Cu的物质的量是1mol,当有0.4mol电子发生转移时,发生反应的Cu的物质的量是0.2mol,质量是0.2mol×64g/mol=12.8g;
(4)铁元素化合价从+3价降低到+2价,得到1个电子,则当有1 mol FeCl3完全反应时,转移的电子数目为NA。

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案