题目内容
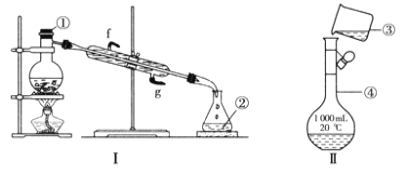
【题目】氯苯是燃料、医药、有机合成的中间体,是重要的有机化工产品。实验室制取氯苯的装置如图所示(加热和固定仪器的装置略去)。回答下列问题:

(1)a和b仪器组合成制取氯气的装置,反应无需加热,则a装置中的固体反应物可以是________(填字母序号)。
A.MnO2 B.KMnO4 C.K2Cr2O7
(2)把氯气通入反应器d中(d装置有FeCl3和苯),加热维持反应温度40~60 ℃,温度过高会生成过多的二氯苯。对d加热的方法是______________________。
(3)装置c出口的气体成分有HCl、Cl2、水蒸气和_____。
(4)制取氯苯的化学方程式为_______________________ 。
(5)装置d中的反应完成后,工业上要进行水洗、碱洗及食盐干燥,才能蒸馏。
①碱洗之前要水洗,其目的是______________________________。
②用10%NaOH溶液碱洗时发生氧化还原反应的化学反应方程式为_____________________。
(6)生成的氯气中存在HCl、H2O等杂质气体,若需要增加一个装置除去水蒸气,请画出该装置图,并标明所用试剂________。
(7)工业生产中苯的流失情况如下表所示:
项目 | 二氯苯 | 氯化尾气 | 蒸气 | 成品 | 不确定苯耗 | 合计 |
苯流失量kg/t | 11.7 | 5.4 | 20.8 | 2.0 | 49.3 | 89.2 |
则10t苯可制得成品氯苯________t(列出计算式即可。氯苯和苯的相对分子质量分别是112.5和78)。
【答案】 BC 水浴加热 苯蒸气 ![]() 洗去FeCl3、Cl2、HCl等无机物,节省碱的用量,降低成本 Cl2+2NaOH===NaCl+NaClO+H2O
洗去FeCl3、Cl2、HCl等无机物,节省碱的用量,降低成本 Cl2+2NaOH===NaCl+NaClO+H2O  10×(1-0.089 2)×
10×(1-0.089 2)×![]()
【解析】(1)高锰酸钾和重铬酸钾氧化性强,二氧化锰制氯气需要加热,高锰酸钾和重铬酸钾不用,
故选BC;(2)反应器C加热控制反应温度在40-60℃,可利用水浴加热;(3)仪器c为球形冷凝管,由于苯易挥发,反应产生的HCl,且有未反应的氯气,D出口气体中含有HCl、苯蒸汽、氯气;(4)制取氯苯的化学方程式为![]() ;(5)①d中反应完成后有l3、HCl等副产品,易溶于水,碱洗之前要水洗,可以洗去这些无机物,节约碱的用量,降低成本;②催化剂氯化铁与氢氧化钠反应,生成HCl会与氢氧化钠反应,溶解的氯气也会与氢氧化钠反应,该反应为氧化还原反应:Cl2+2NaOH=NaCl+NaClO+H2O;(6)浓硫酸用于吸收水蒸气,导气管应长进短出,装置为:
;(5)①d中反应完成后有l3、HCl等副产品,易溶于水,碱洗之前要水洗,可以洗去这些无机物,节约碱的用量,降低成本;②催化剂氯化铁与氢氧化钠反应,生成HCl会与氢氧化钠反应,溶解的氯气也会与氢氧化钠反应,该反应为氧化还原反应:Cl2+2NaOH=NaCl+NaClO+H2O;(6)浓硫酸用于吸收水蒸气,导气管应长进短出,装置为: ;(7)苯的总流失量为89.2Kg/t,故1t苯中参加反应的苯的质量为(1t-0.0892t),由苯与氯苯质量之比为78:112.5,则10t 苯可制得成品氯苯为:10×(1-0.089 2)×
;(7)苯的总流失量为89.2Kg/t,故1t苯中参加反应的苯的质量为(1t-0.0892t),由苯与氯苯质量之比为78:112.5,则10t 苯可制得成品氯苯为:10×(1-0.089 2)×![]() t;
t;