题目内容
【题目】请按要求回答下列问题:
I.25℃时,物质的量浓度均为0.1mol/L的几种盐溶液的pH如表:
序号 | ① | ② | ③ | ④ |
溶液 | NH4Cl | CH3COONH4 | NaHCO3 | Na2CO3 |
pH | 5 | 7 | 8.4 | 11.6 |
(1)用离子方程式解释溶液④能去除油污的原因________________________。
(2)写出溶液③中电荷守恒的关系式:_________________________________________。
(3)25℃时,溶液①中,由水电离产生的c(OH-)=_______mol/L;
根据溶液②,Ka(CH3COOH )_____Kb(NH3·H2O) (填“>”、“<”或“=”)。
II.根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2) 表面与水发生下列反应,
(1)已知: N2(g) + 3H2(g)![]() 2NH3(g) △H=-92.4kJ·mol-1
2NH3(g) △H=-92.4kJ·mol-1
2H2(g) + O2(g)= 2H2O (1) △H =-571.6kJ·mol-1
则2N2(g) + 6H2O(1)![]() 4NH3(g) + 3O2(g) △H=______。
4NH3(g) + 3O2(g) △H=______。
(2)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得: 3SiO2(s)+ 6C(s) + 2N2(g) ![]() Si3N4(s)+ 6CO(g)。该反应的平衡常数表达式为K=_________。
Si3N4(s)+ 6CO(g)。该反应的平衡常数表达式为K=_________。
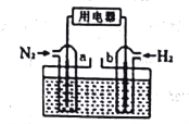
(3)以N2和H2为反应物(如下图),盐酸酸化的NH4Cl溶液为电解质的原电池,a电极的电极反应式为:____________________________________________。
【答案】 CO32-+ H2O![]() HCO3-+OH- c(OH-)+ 2c(CO32-) + c(HCO3-) =c(H+)+ c(Na+) 10-5 = + 1530 kJ·mol-1
HCO3-+OH- c(OH-)+ 2c(CO32-) + c(HCO3-) =c(H+)+ c(Na+) 10-5 = + 1530 kJ·mol-1 ![]() N2 + 6e- + 8H+ = 2NH4+
N2 + 6e- + 8H+ = 2NH4+
【解析】I. (1). 在Na2CO3溶液中,碳酸根离子水解使溶液呈碱性,水解方程式为:CO32-+ H2O![]() HCO3-+OH-,碱性条件下可以促进油污水解,从而达到除油污的目的,故答案为:CO32-+ H2O
HCO3-+OH-,碱性条件下可以促进油污水解,从而达到除油污的目的,故答案为:CO32-+ H2O![]() HCO3-+OH-;
HCO3-+OH-;
(2). 在NaHCO3溶液中,存在的离子有:Na+、H+、OH-、HCO3-、CO32-,电荷守恒式为:c(OH-)+ 2c(CO32-) + c(HCO3-) =c(H+)+ c(Na+),故答案为:c(OH-)+ 2c(CO32-) + c(HCO3-) =c(H+)+ c(Na+);
(3). 25℃时,NH4Cl溶液的pH=5,铵根离子结合水电离出的氢氧根离子生成一水合氨,溶液显酸性,由水电离产生的c(OH)水=c(H+)水=105mol/L,CH3COONH4溶液pH=7,溶液呈中性,说明醋酸根离子和铵根离子水解程度相同,则Ka(CH3COOH)=Kb(NH3H2O),故答案为:105;=;
II. (1). 已知:① N2(g) + 3H2(g)![]() 2NH3(g) △H=-92.4kJ·mol-1
2NH3(g) △H=-92.4kJ·mol-1
② 2H2(g) + O2(g)= 2H2O (1) △H =-571.6kJ·mol-1 ,根据盖斯定律①×2-②×3可得:2N2(g) + 6H2O(1)![]() 4NH3(g) + 3O2(g) △H=(-92.4kJ·mol-1 )×2-(-571.6kJ·mol-1)×3= +1530 kJ·mol-1,故答案为:+1530 kJ·mol-1;
4NH3(g) + 3O2(g) △H=(-92.4kJ·mol-1 )×2-(-571.6kJ·mol-1)×3= +1530 kJ·mol-1,故答案为:+1530 kJ·mol-1;
(2). 由反应方程式 3SiO2(s)+ 6C(s) + 2N2(g) ![]() Si3N4(s)+ 6CO(g)可知,该反应的平衡常数表达式为K=
Si3N4(s)+ 6CO(g)可知,该反应的平衡常数表达式为K=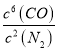 ,故答案为:
,故答案为: 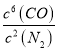 ;
;
(3). 该电池的本质反应是氮气和氢气合成氨的反应,在该原电池中,氢气在负极失电子发生氧化反应,氮气在正极得电子发生还原反应,则a电极反应式为N2 + 6e- + 8H+ = 2NH4+,故答案为:N2 + 6e- + 8H+ = 2NH4+。

 阅读快车系列答案
阅读快车系列答案