题目内容
据报道,美国已经找到名为Trans的铁系催化剂,使氮气和氢气能在常温常压下合成氨。该催化剂的作用是
| A.降低生产能耗 | B.使反应物的化学键不需破坏 |
| C.使反应更完全 | D.使反应放出更多的热量 |
A
解析试题分析:A.催化剂的作用是降低反应的活化能,使反应能够在较低的温度下发生,从而提高活化分子的百分数,化学反应速率大大加快。正确。B.任何化学反应发生都要断裂反应物中的化学键,形成新的化学键,所以B是错误的。C.催化剂对化学平衡的移动无影响,不能使化学平衡发生移动,故物质的转化率也不变。错误。D. 但是它不能改变反应物生成物的能量,因此不会影响反应热的多少。错误。
考点:考查催化剂与反应热、键能、化学反应速率、化学平衡移动的关系的知识。

煤气是生活中常用的燃料,制取水煤气的反应为C(s)+H2O(g) CO(g)+H2(g)。该反应在一容积可变的密闭容器中进行时,改变下列条件会对反应速率产生影响的是
CO(g)+H2(g)。该反应在一容积可变的密闭容器中进行时,改变下列条件会对反应速率产生影响的是
①增加少量的碳 ②将容器的体积缩小一半 ③保持体积不变,充入N2使体系压强增大 ④保持压强不变,充入N2使体系体积增大
| A.①② | B.②③ | C.②④ | D.①④ |
在2 L的密闭容器中进行如下反应: CO(g)+H2O(g) CO2(g)+H2(g),有如下数据:
CO2(g)+H2(g),有如下数据:
| 实验 | 温度/℃ | 起始量/mol | 平衡量/mol | |||
| CO | H2O | CO2 | H2 | CO2 | ||
| 1 | 650 | 2.0 | 1.0 | 0 | 0 | 0.8 |
| 2 | 800 | 2.0 | 2.0 | 0 | 0 | 1.0 |
A.正反应为吸热反应
B.实验1中,CO的转化率为80%
C.650℃时,化学平衡常数K=8/3
D.实验1再加入1.0 mol H2O,重新达到平衡时,n (CO2)为1.6 mol
在2L密闭容器中,保持恒温,加热KClO3和MnO2固体混合物制取O2,5min后,生成O232克,则此反应的平均速率可表示为( )
| A.v(O2)=3.2g·L-1·min-1 | B.v(O2)=0.1 mol·L-1·min-1 |
| C.v(KCl)=0.1 mol·L-1·min-1 | D.v(KClO3)=0.0667 mol·L-1·min-1 |
在一定温度下,将一定量的气体通入体积为2L的密闭容器中,使其发生反应,,有关物质X、Y、Z的物质的量的变化如图所示。则下列有关推断正确的是( ) 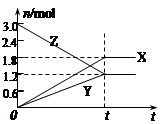
| A.该反应的化学方程式为: 3Z = 3X+2Y |
| B.t0时,X、Y、Z的质量不再改变 |
| C.t0时,Z的浓度为1.2 mol/L |
| D.t0时,反应停止,反应速率为0 |
反应m A + n B  p C中,m、n、p为各物质的计量数。现测得C每分钟增加a mol/L,B每分钟减少1.5a mol/L,A每分钟减少0.5a mol/L,则m:n:p为
p C中,m、n、p为各物质的计量数。现测得C每分钟增加a mol/L,B每分钟减少1.5a mol/L,A每分钟减少0.5a mol/L,则m:n:p为
| A.2:3:1 | B.1:3:2 | C.2:3:3 | D.3:2:1 |
某温度时,在密闭容器中X、Y、Z三种气体浓度的变化如图甲所示,若其他条件不变,当温度分别为T1和T2时,Y的体积分数与时间关系如图乙所示。则下列结论正确的是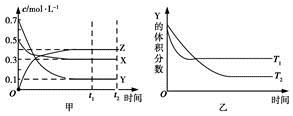
A.该反应的热化学方程式为X(g)+3Y(g)  2Z(g) ΔH>0 2Z(g) ΔH>0 |
| B.若其他条件不变,升高温度,正、逆反应速率均增大,X的转化率减小 |
| C.达到平衡后,若其他条件不变,减小容器体积,平衡向逆反应方向移动 |
| D.达到平衡后,若其他条件不变,通入稀有气体,平衡向正反应方向移动 |
下列各图与表述不一致的是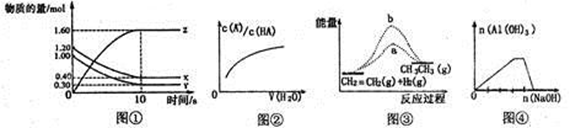
| A.图①表示T℃时,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线。若T℃时,若起始时X为1.20mol,Y为1.00mol,则平衡时Y的转化率为80% |
| B.图②中曲线表示向弱酸HA的稀溶液中加水稀释 |
| C.图③b曲线表示反应CH2=CH2(g)+H2(g)→CH3-CH3(g) △H<0,使用催化剂时,反应过程中的能量变化 |
| D.图④表示向NH4Al(SO4)2溶液中滴加过量的NaOH溶液 |
 2C(g)+2D(g),在不同条件下的化学反应速率,其中反应速率最快的是( )
2C(g)+2D(g),在不同条件下的化学反应速率,其中反应速率最快的是( )