题目内容
在2 L的密闭容器中进行如下反应: CO(g)+H2O(g) CO2(g)+H2(g),有如下数据:
CO2(g)+H2(g),有如下数据:
| 实验 | 温度/℃ | 起始量/mol | 平衡量/mol | |||
| CO | H2O | CO2 | H2 | CO2 | ||
| 1 | 650 | 2.0 | 1.0 | 0 | 0 | 0.8 |
| 2 | 800 | 2.0 | 2.0 | 0 | 0 | 1.0 |
A.正反应为吸热反应
B.实验1中,CO的转化率为80%
C.650℃时,化学平衡常数K=8/3
D.实验1再加入1.0 mol H2O,重新达到平衡时,n (CO2)为1.6 mol
C
解析试题分析:A、通过计算实验1中的化学平衡常数是8/3,实验2中的化学平衡常数是1,所以升高温度,平衡常数减小,说明升温,平衡逆向移动,该反应是放热反应,错误;B、实验1中由二氧化碳的物质的量可计算CO消耗的物质的量是0.8mol,所以CO的转化率是0.8mol/2.0mol×100%=40%,错误;C、实验1中平衡时CO、H2O、CO2、H2的平衡浓度分别是0.6mol/L、0.1 mol/L、0.4 mol/L、0.4 mol/L,化学平衡常数为8/3,正确;D、实验1再加入1.0 mol H2O,重新达到平衡时,若n (CO2)为1.6 mol,可计算此时的平衡常数为16,而平衡常数只是温度常数,温度不变,平衡常数不变,所以平衡时,n (CO2)不可能为1.6 mol,错误,答案选C。
考点:考查化学平衡常数的计算与应用,转化率的计算,热效应的判断

一定条件下,在体积为10 L的固定容器中发生反应:N2(g)+3H2(g)  ?2NH3(g) ΔH<0,反应过程如图:下列说法正确的是
?2NH3(g) ΔH<0,反应过程如图:下列说法正确的是
| A.t1 min时正、逆反应速率相等。 |
| B.X曲线表示NH3的物质的量随时间变化的关系 |
C.0~8 min,H2的平均反应速率v(H2)=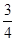 mol·L-1·min-1 mol·L-1·min-1 |
| D.10~12 min,升高温度使反应速率加快,平衡正向移动 |
据报道,美国已经找到名为Trans的铁系催化剂,使氮气和氢气能在常温常压下合成氨。该催化剂的作用是
| A.降低生产能耗 | B.使反应物的化学键不需破坏 |
| C.使反应更完全 | D.使反应放出更多的热量 |
在一定条件下,反应N2+3H2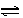 2NH3,在2L密闭容器中进行,5min内氨的质量增加了1.7g,则反应速率为
2NH3,在2L密闭容器中进行,5min内氨的质量增加了1.7g,则反应速率为
| A.v(H2)=0.03mol/(L·min) | B.v(N2)="0.005mol/(L·min)" |
| C.v(NH3)=0.17mol/(L·min) | D.v(NH3)=0.02mol/(L·min) |
下列措施对增大反应速率明显有效的是
| A.在K2SO4与BaCl2两溶液反应时,增大压强 |
| B.Fe与稀硫酸反应制取H2时,改用浓硫酸 |
| C.Na与水反应时增大水的用量 |
| D.Al在氧气中燃烧生成A12O3,将Al片改成Al粉 |
如图是可逆反应N2(g)+3H2(g) 2NH3(g) 在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )
2NH3(g) 在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )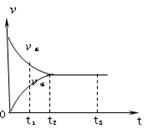
| A.t1时,只有正方向反应 | B.t2时,反应到达限度 |
| C.t2-t3,反应不再发生 | D.t2-t3,各物质的浓度相等且不再发生变化 |
已知汽车尾气无害化处理反应为2NO(g)+2CO(g) N2(g)+2CO2(g),下列说法中正确的是
N2(g)+2CO2(g),下列说法中正确的是
| A.使用适当的催化剂不改变反应速率 | B.降低压强能提高反应速率 |
| C.升高温度能提高反应速率 | D.改变压强对反应速率无影响 |
 2Z(g);△H<0,达到平衡后,仅改变横坐标条件,下列图像正确的是
2Z(g);△H<0,达到平衡后,仅改变横坐标条件,下列图像正确的是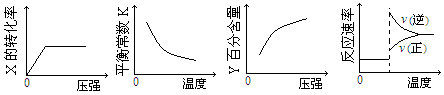
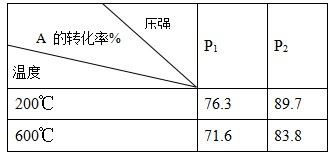
 2C(g)在不同温度和压强时A的转化率如表所示。由此可知,下列图像正确的是
2C(g)在不同温度和压强时A的转化率如表所示。由此可知,下列图像正确的是