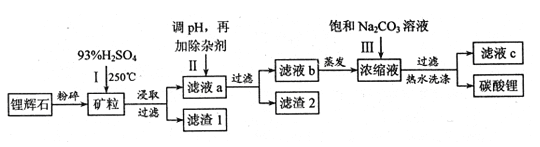
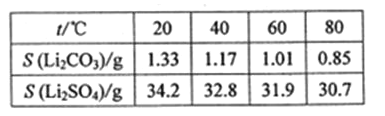
题目内容
【题目】工业上用铝土矿(主要成分为Al2O3,含SiO2、Fe2O3等杂质)为原料冶炼铝的工艺流程如下图所示:

对上述流程中的判断正确的是( )
①试剂X为稀硫酸,沉淀中含有硅的化合物
②反应 II 中生成Al(OH)3的反应为:CO2+AlO2-+2H2O═Al(OH)3↓+HCO3-
③结合质子(H+) 的能力由弱到强的顺序是OH->AlO2->CO32-
④Al2O3熔点很高,工业上还可采用电解熔融AlCl3冶炼Al
A. ①② B.②③ C.①④ D.③④
【答案】B
【解析】
试题分析:①Al2O3、Fe2O3和硫酸反应,SiO2和硫酸不反应,要将氧化铝和其他两种分离出来,应该选择氢氧化钠,将氧化铝溶解为偏铝酸钠,则固体难溶物是氧化铁和二氧化硅,即试剂X为氢氧化钠,沉淀中含有二氧化硅和氧化铁,错误;②铝土矿(主要成分为Al2O3,含SiO2、Fe2O3等杂质)中加入过量的氢氧化钠以后会生成偏铝酸钠溶液,偏铝酸盐中通二氧化碳来获得氢氧化铝沉淀,即CO2+AlO2-+2H2O═Al(OH)3↓+HCO3-,正确;③结合质子的能力就是指碱性,结合质子能力越强,相应的酸放出质子的能力就越弱,其对应的酸的酸性就越弱,显然酸性强弱HCO3->Al(OH)3>H2O,碱性:OH->AlO2->HCO3-,所以结合质子能力:OH->AlO2->CO32->HCO3-,正确;④氯化铝是分子晶体,熔融时不存在铝离子,电解熔融的氯化铝不能获得金属铝,错误,答案选B。

练习册系列答案
相关题目