题目内容
SF6是一种优良的气体绝缘材料,分子结构中只存在S—F键。发生反应的热化学方程式为:S(s)+3F2(g) = SF6(g) ΔH=" ―1220" kJ/mol 。已知:1mol S(s) 转化为气态硫原子吸收能量280kJ,断裂1mol F—F 键需吸收的能量为160 kJ ,则断裂1mol S—F 键需吸收的能量为
| A.330 kJ | B.276.67 kJ | C.130 kJ | D.76.67 kJ |
A
解析

练习册系列答案
相关题目
相同温度下,体积均为0.25L的两个恒容密闭容器中发生可逆反应:X2(g)+3Y2(g) 2XY3(g) △H=-92.6kJ·mol-1
2XY3(g) △H=-92.6kJ·mol-1
起始时各物质物质的量如下表所示:
| 容器 编号 | 起始时各物质物质的量/mol | ||
| X2 | Y2 | XY3 | |
| ① | 1 | 3 | 0 |
| ② | 0.6 | 1.8 | 0.8 |
达到平衡后,①容器中XY3的物质的量为0.5mol。下列叙述正确的是
A.容器①、②中反应的平衡常数不相等
B.达平衡时,容器②中 XY3的物质的量浓度为2mol·L—1
C.容器①中反应达到平衡时放出的热量为23.15 kJ
D.容器②中反应达到平衡时放出热量
下列对有关反应能量变化图像的判断错误的是( )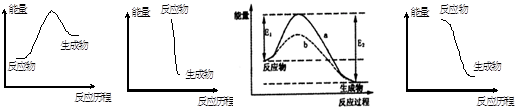
I Ⅱ Ⅲ Ⅳ
| A.I可表示需加热的放热反应 |
| B.Ⅱ可表示爆炸反应 |
| C.Ⅲ可表示无催化剂(a)和有催化剂(b)时反应的能量变化 |
| D.Ⅳ可表示醋酸和碱的中和反应 |
根据碘与氢气反应的热化学方程式
(i)I2(g)+ H2(g)  2HI(g)+ 9.48 kJ (ii) I2(s)+ H2(g)
2HI(g)+ 9.48 kJ (ii) I2(s)+ H2(g) 2HI(g) - 26.48 kJ
2HI(g) - 26.48 kJ
下列判断正确的是
| A.1mol I2(s)中通入2gH2(g),反应吸热26.48 kJ |
| B.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ |
| C.反应(ii)的反应物总能量比反应(i)的反应物总能量低 |
| D.反应(i)放出的热量多,所以产物的能量低,比反应(ii)的产物更稳定 |
参照反应Br + H2 HBr +H的能量对反应历程的示意图,下列对上述正反应叙述中正确的
HBr +H的能量对反应历程的示意图,下列对上述正反应叙述中正确的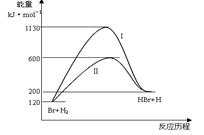
| A.反应热:过程I>过程Ⅱ |
| B.反应速率:过程Ⅱ=过程I |
| C.该反应为吸热反应 |
| D.过程I使用了催化剂 |
氢气虽然是一种理想的绿色能源,但目前仍处在研究、实验阶段,还未得到广泛应用,其原因可能是
| A.氢气虽可由水制备获得,但水资源严重匮乏 |
| B.氢气制备耗能巨大,廉价制氢技术尚未成熟 |
| C.氢气贮存、运输等安全技术已经很好地解决了 |
| D.氢气燃烧产物虽无污染,但其放出热量较少 |
下列热化学方程式中,ΔH的绝对值能表示可燃物的燃烧热的是( )
A.C(s)+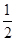 O2(g)===CO(g) ΔH=-110.5 kJ·mol-1 O2(g)===CO(g) ΔH=-110.5 kJ·mol-1 |
| B.CH4(g)+2O2(g)===CO2(g)+2H2O(g)ΔH=-802.3 kJ·mol-1 |
| C.2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1 |
D.CO(g)+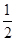 O2(g)===CO2(g) ΔH=-283 kJ·mol-1 O2(g)===CO2(g) ΔH=-283 kJ·mol-1 |
根据下图可以写出热化学方程式As2O5(s) = As2O3( s) +O2( g) △H =" a" kJ/mol。则a为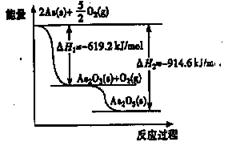
| A.+1533.8 | B.— 1533.8 | C.+295.4 | D.—295.4 |
 H[CuCl2]。反应结束后将溶液倒入蒸馏水中有CuCl生成。实验过程中加入浓盐酸的目的是 。当c(Cl-)=2×10-3 mol·L—1时, c(Cu+-)= mol·L—1。已知:Ksp(CuCl)=1.7×10-7
H[CuCl2]。反应结束后将溶液倒入蒸馏水中有CuCl生成。实验过程中加入浓盐酸的目的是 。当c(Cl-)=2×10-3 mol·L—1时, c(Cu+-)= mol·L—1。已知:Ksp(CuCl)=1.7×10-7