题目内容
以甲醇为替代燃料是解决我国石油资源短缺的重要措施。
(1)CO、CO2可用于甲醇的合成,其相关反应的热化学方程式如下:
CO(g)+2H2(g)=CH3OH(g) △H=" -102.5" kJ·mol-1
CO(g)+H2O(g) = CO2(g)+H2(g) △H="-42.9" kJ·mol-1
则反应CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H= kJ·mol-1
反应CO(g)+H2O(g) = CO2(g)+H2(g)的平衡常数K的表达式为 。
(2)用CO2合成甲醇时可选用亚铬酸锌(ZnCr2O4)或CuCl为催化剂。
①工业制备亚铬酸锌是用CO还原ZnCrO4·H2O,同时生成ZnO。该反应的化学方程式是 。以亚铬酸锌为催化剂时,工业上的适宜温度是:350℃~420℃,可能的原因是 。
② CuCl是不溶于水的白色固体,制备时向CuCl2溶液中加入过量铜粉,发生反应CuCl2+Cu=2CuC1。在实验过程中应先加入浓盐酸,发生反应CuCl + HCl H[CuCl2]。反应结束后将溶液倒入蒸馏水中有CuCl生成。实验过程中加入浓盐酸的目的是 。当c(Cl-)=2×10-3 mol·L—1时, c(Cu+-)= mol·L—1。已知:Ksp(CuCl)=1.7×10-7
H[CuCl2]。反应结束后将溶液倒入蒸馏水中有CuCl生成。实验过程中加入浓盐酸的目的是 。当c(Cl-)=2×10-3 mol·L—1时, c(Cu+-)= mol·L—1。已知:Ksp(CuCl)=1.7×10-7
(3)直接甲醇燃料电池结构如图所示,则负极反应是 。
(1)- 59.6 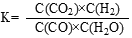
(2)①2ZnCrO4·H2O+3CO="ZnO+" ZnCr2O4+3CO2+2H2O
此时催化剂亚铬酸锌的活性最大 或温度升高,反应速率增大
②促使平衡正向移动,防止CuCl固体覆盖在Cu表面,影响反应的进行 8.5×10-5
(3)CH3OH+H2O-6e-=CO2+6H+
解析试题分析:(1)两个方程式相减,△H=-102.5-(-42.9)= - 59.6 kJ·mol-1;(2)催化剂一般有温度使用条件,保证其活性最大,反应速率最快,催化效果最好;(3)因为该反应生成难溶的CuCl固体覆盖在Cu表面阻碍反应继续进行,因此需要将CuCl固体溶解除掉,促使平衡正向移动;(4)该电池介质是酸性,负极为甲醇反应生成CO2,根据化合价的变化确定失去电子数目,电极反应式为CH3OH+H2O-6e-=CO2+6H+。
考点:考查化学反应原理中的反应热的计算、平衡常数表达式的书写、反应速率、平衡移动及电极反应式书写等内容。

“低碳经济,节能减排”是21世纪世界经济发展的新思路。”下列与之相悖的是( )
| A.开发水能、风能、太阳能、地热能、核能等新能源,减少使用煤、石油等化石燃料 |
| B.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源 |
| C.大力开采煤、石油和天然气,以满足经济发展的需要 |
| D.大力发展新能源汽车,如混合动力汽车、电动汽车等,以减少碳、氮氧化物的排放 |
臭氧层是地球上生物的保护层,在平流层存在:2O3 3O2 ;O3
3O2 ;O3 O+ O2。某些微粒X(X为Cl、Br等) 能加速O3的分解:X+O3→XO+ O2; XO+O→X + O2。已知: 2O3
O+ O2。某些微粒X(X为Cl、Br等) 能加速O3的分解:X+O3→XO+ O2; XO+O→X + O2。已知: 2O3 3O2 +144.8 kJ ; t ℃时K=3×1076。下列说法错误的是
3O2 +144.8 kJ ; t ℃时K=3×1076。下列说法错误的是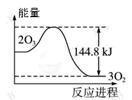
| A.氟利昂释放出的氯原子是臭氧层中促进O3分解的催化剂 |
| B.高压放电条件下O2可以转化成O3 |
| C.O3转变为O2时的能量变化可用右图表示 |
D.t ℃时3O2 2O3 K≈3.33×10-77 2O3 K≈3.33×10-77 |
下列有关能量的判断或表示方法正确的是( )
| A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量更多 |
B.从C(石墨) → C(金刚石) Q Q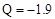 kJ,可知石墨比金刚石更稳定 kJ,可知石墨比金刚石更稳定 |
C.由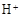 (aq) (aq) (aq) → H2O(l) (aq) → H2O(l) Q Q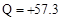 kJ,可知:含1mol CH3COOH的稀溶液与含1mol NaOH的稀溶液混合,放出热量等于57.3 kJ kJ,可知:含1mol CH3COOH的稀溶液与含1mol NaOH的稀溶液混合,放出热量等于57.3 kJ |
D.2gH2完全燃烧生成液态水放出285.8kJ热量,则氢气燃烧的热化学方程式为:2H2(g) O2(g) → 2H2O(l) O2(g) → 2H2O(l) Q Q 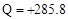 kJ kJ |
下列说法不正确的是
A.水解反应NH4++H2O NH3·H2O+H+达到平衡后,升高温度平衡正向移动 NH3·H2O+H+达到平衡后,升高温度平衡正向移动 |
| B.在海轮的外壳上镶入锌块,可减缓船体的腐蚀速率 |
| C.明矾水解生成Al(OH)3胶体,可用作净水剂 |
| D.如图所示的反应过程中A+B→X的△H<0,X→C的△H>0 |
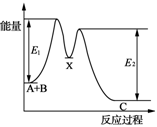
下列说法正确的是:( )
A.在100 ℃.101 kPa条件下,液态水的气化热为40.69 kJ·mol-1,则H2O(g) H2O(l) 的ΔH ="+" 40.69 kJ·mol-1 H2O(l) 的ΔH ="+" 40.69 kJ·mol-1 |
| B.已知MgCO3的Ksp = 6.82 × 10-6,则所有含有固体MgCO3的溶液中,都有c(Mg2+) = c(CO32-),且c(Mg2+) · c(CO32-)= 6.82 × 10-6 |
| C.常温下,在0.10 mol·L-1的NH3·H2O溶液中加入少量NH4Cl晶体,能使NH3·H2O的电离度降低,溶液的pH减小 |
| D.已知: |
| 共价键 | C-C | C=C | C-H | H-H |
| 键能/ kJ·mol-1 | 348 | 610 | 413 | 436 |
则可以计算出反应
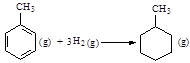 的ΔH为-384 kJ·mol-1
的ΔH为-384 kJ·mol-1 下列各组中的两种物质作用,反应条件(温度或者反应物用量)改变,不会引起产物种类改变的是( )
| A.Na和O2 | B.NaOH和CO2 |
| C.Na2O2和CO2 | D.AlCl3和NaOH |
(16分) 碳及其化合物有广泛的用途。
(1)反应C(s)+ H2O(g) 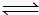 CO(g) +H2(g) ΔH=" +131.3" kJ?mol-1,达到平衡后,体积不变时,以下有利于提高H2产率的措施是 。
CO(g) +H2(g) ΔH=" +131.3" kJ?mol-1,达到平衡后,体积不变时,以下有利于提高H2产率的措施是 。
| A.增加碳的用量 | B.升高温度 | C.用CO吸收剂除去CO | D.加入催化剂 |
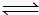 2CO(g) △H=+172.5kJ?mol-1
2CO(g) △H=+172.5kJ?mol-1则反应 CO(g)+H2O(g)
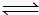 CO2(g)+H2(g) 的△H= kJ?mol-1。
CO2(g)+H2(g) 的△H= kJ?mol-1。(3)CO与H2一定条件下反应生成甲醇(CH3OH),甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨做电极,该电池负极反应式为 。
(4)在一定温度下,将CO(g)和H2O(g)各0.16 mol分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g)
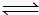 CO2(g)+H2(g),得到如下数据:
CO2(g)+H2(g),得到如下数据:| t / min | 2 | 4 | 7 | 9 |
| n(H2O)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
②该温度下,此反应的平衡常数K=______ _____;
③其它条件不变,再充入0.1mol CO和0.1mol H2O(g),平衡时CO的体积分数______(填“增大”、“减小”或“不变”)。