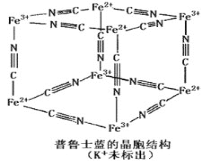
题目内容
【题目】表代表周期表中的几种短周期元素,下列说法中错误的是

A. A、B、C第一电离能的大小顺序为C>B>A
B. C、D气态氢化物稳定性强弱和沸点高低均为C>D
C. AD3和ED4两分子的中心原子均为sp3杂化
D. ED4分子中各原子均达8电子结构
【答案】A
【解析】
试题同周期自左而右元素第一电离能呈增大趋势,但N元素原子2p能级容纳3个电子,处于半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能:F>N>O,故A错误;非金属性F>Cl非金属性越强,氢化物越稳定,故氢化物稳定性HF>HCl,HF分子之间存在氢键,沸点高于HCl,故B正确;同周期自左而右元素第一电离能呈增大趋势,但N元素原子2p能级容纳3个电子,处于半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能:F>N>O,故A错误;C.NCl3中N原子价层电子对数=3+![]() =4;SiCl4分子的Si原子价层电子对数=4+
=4;SiCl4分子的Si原子价层电子对数=4+![]() =4,二者中心原子均为sp3杂化,故C正确;D.SiCl4分子中Si、Cl的化合价绝对值与其原子最外层电子数之和都等于8,均达8电子结构,故D正确;答案选A
=4,二者中心原子均为sp3杂化,故C正确;D.SiCl4分子中Si、Cl的化合价绝对值与其原子最外层电子数之和都等于8,均达8电子结构,故D正确;答案选A

 优加精卷系列答案
优加精卷系列答案【题目】某工业废水中仅含表中的离子中的5种(不考虑水的电离及离子的水解),且各种离子的物质的量浓度相等,均为0.1mol/L。
阳离子 | K+ Cu2+ Fe3+ Al3+ Fe2+ |
阴离子 | Cl- CO32- NO3- SO42- SiO32- |
甲同学欲探究废水的组成,进行了如下实验:
I.用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察)。
Ⅱ.取少量溶液,加入KSCN溶液无明显变化。
Ⅲ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
Ⅳ.向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:
(1)Ⅲ中加入少量盐酸生成无色气体的离子方程式是____________________。
(2)将Ⅲ中红棕色气体(标况下)收集一满试管然后倒扣入水中(假设溶质不扩散),所得溶液的物质的量浓度为___________mol/L(精确到千分位)。
(3)甲同学最终确定原溶液中所含离子是__________________。
(4)另取100mL原溶液,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体质量为_____________g。