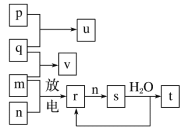
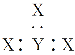题目内容
【题目】(1)KClO3 + 6HCl(浓) = KCl + 3Cl2 + 3H2O中氧化剂是__________,还原剂是__________,请用双线桥表示电子转移数目_________________。当有l mol Cl2生成时,氧化剂与还原剂的物质的量之比为____________。
(2)3NO2 + H2O = 2HNO3 + NO中当电子转移4mol时,参加还原反应的NO2有__________mol,氧化产物与还原产物物质的量之比为__________。
【答案】KClO3 HCl  1:5 6 2:1
1:5 6 2:1
【解析】
(1)反应KClO3 + 6HCl(浓) = KCl + 3Cl2 + 3H2O中,只有Cl元素化合价发生变化,Cl元素化合价分别由+5价、-1价变化为0价,当有3mol Cl2生成时,转移5mol电子,以此解答该题;
(2)反应二氧化氮中氮元素化合价既升高也降低,二氧化氮既作氧化剂又作还原剂,3mol的NO2中,2mol做还原剂,1mol做氧化剂,转移的电子为2mol,以此解答该题。
(1)反应KClO3 + 6HCl(浓) = KCl + 3Cl2 + 3H2O中,只有Cl元素化合价发生变化,KClO3为氧化剂,HCl为还原剂,当有3mol Cl2生成时,转移5mol电子,则电子转移的方向和数目为 ,当有1mol Cl2生成时,氧化剂与还原剂的物质的量之比为
,当有1mol Cl2生成时,氧化剂与还原剂的物质的量之比为![]() mol:
mol:![]() mol=1:5;
mol=1:5;
(2)3NO2+H2O=2HNO3+NO中,只有N元素的化合价变化,由生成NO可知,生成1molNO时转移2mol电子且有3molNO2反应,当电子转移4mol时,参加还原反应的NO2有6mol,HNO3为氧化产物,NO为还原产物,由反应可知,氧化产物与还原产物物质的量之比为2:1。