题目内容
【题目】设NA为阿伏加德罗常数,下列说法中正确的是( )
A.0.1mol/L Na2SO4溶于水中,所得溶液中Na+个数为0.2NA
B.78g Na2O2中含有离子总数为3NA
C.标准状况下,NA个水分子所占的体积为22.4L
D.Na2O2与CO2反应生成2.24L氧气转移电子数为0.2NA
【答案】B
【解析】
A.不知道溶液的体积,无法算出溶质的物质的量,故A错误;
B.78g Na2O2中物质的量是![]() =1mol,一个过氧化钠含有两个钠离子和一个过氧根离子即是三个离子,所以1mol过氧化钠含有离子总数为3NA,故B正确;
=1mol,一个过氧化钠含有两个钠离子和一个过氧根离子即是三个离子,所以1mol过氧化钠含有离子总数为3NA,故B正确;
C. 标准状况下,水是液体,不能使用气体摩尔体积22.4L/mol,故C错误;
D. 使用气体摩尔体积时,必须注明气体所处的温度和压强,故D错误;
故选:B。

 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案【题目】将H2S转化为可再利用的资源是能源研究领域的重要课题。
(1)H2S的转化
Ⅰ | 克劳斯法 |
|
Ⅱ | 铁盐氧化法 |
|
Ⅲ | 光分解法 |
|
① 反应Ⅰ的化学方程式是________。
② 反应Ⅱ:____+ 1 H2S ==____Fe2+ + ____S↓ + ____(将反应补充完整)。
③ 反应Ⅲ体现了H2S的稳定性弱于H2O。结合原子结构解释二者稳定性差异的原因:_______。
(2)反应Ⅲ硫的产率低,反应Ⅱ的原子利用率低。我国科研人员设想将两个反应耦合,实现由H2S高效产生S和H2,电子转移过程如图。
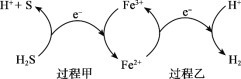
过程甲、乙中,氧化剂分别是______。
(3)按照设计,科研人员研究如下。
① 首先研究过程乙是否可行,装置如图。经检验,n极区产生了Fe3+,p极产生了H2。n极区产生Fe3+的可能原因:
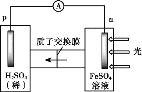
ⅰ.Fe2+ - e- = Fe3+
ⅱ.2H2O -4e-=O2 +4H+,_______(写离子方程式)。经确认,ⅰ是产生Fe3+的原因。过程乙可行。
② 光照产生Fe3+后,向n极区注入H2S溶液,有S生成,持续产生电流,p极产生H2。研究S产生的原因,设计如下实验方案:______。 经确认,S是由Fe3+氧化H2S所得,H2S不能直接放电。过程甲可行。
(4)综上,反应Ⅱ、Ⅲ能耦合,同时能高效产生H2和S,其工作原理如图。
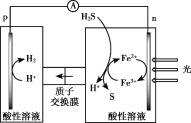
进一步研究发现,除了Fe3+/Fe2+ 外,I3-/I- 也能实现如图所示循环过程。结合化学用语,说明I3-/I- 能够使S源源不断产生的原因:________。