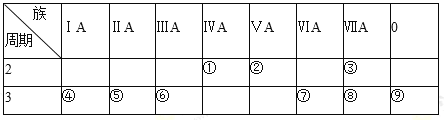
题目内容
【题目】某学生用 NaOH 标准溶液滴定未知浓度的盐酸,进行了如下实验:
取 15.00mL 待测溶液于 250mL 锥形瓶中,加入 1~2 滴酚酞试液,用 NaOH 标准溶液滴定。按上述操作方 法再重复 2 次。
(1)填空:(①、②小题中选填“偏高”、“偏低”或“无影响”)
①装碱滴定管用蒸馏水洗涤后,直接加入 NaOH 标准溶液进行滴定,则待测液的浓度_____;
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去 NaOH 标准溶液的体积_____;
③滴定时边滴边摇动锥形瓶,眼睛应观察_____;
④滴定达到终点时,酚酞指示剂由_____色变成_____色。
(2)滴定结果如下表所示:

若 NaOH 标准溶液的浓度为 0.1010mol/L,则待测液的浓度为_____。
【答案】偏高 无影响 锥形瓶内溶液颜色的变化 无 浅红 0.1347mol/L
【解析】
(1)根据c(待测)=c(标准)×V(标准)/V(待测)分析不当操作对相关物理量的影响,以此判断浓度的误差.
①根据滴定管没有润洗,导致待装液浓度减小分析;
②根据锥形瓶中有水,不影响待测液的物质的量分析;
③酸碱中和滴定时,眼睛要注视锥形瓶内溶液的颜色变化;
④根据反应结束前,溶液为无色,反应结束后滴入氢氧化钠溶液,溶液显示红色分析;
(2)计算出两次滴定消耗标准液体积的平均值,然后根据中和反应实质计算出该盐酸的浓度.
(1)①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,导致标准液的浓度减小,滴定时消耗的标准液的体积增大,c(待测)=c(标准)×V(标准)/V(待测),则HCl溶液浓度偏高;
②锥形瓶用蒸馏水洗涤后,水未倒尽,对待测液氯化氢的物质的量没有影响,则滴定时用去NaOH标准溶液的体积无影响,对结果没有影响;
③酸碱中和滴定时,眼睛要注视锥形瓶内溶液的颜色变化,以便及时判断滴定终点;
④待测液是盐酸,标准液是氢氧化钠溶液,待测液中加入酚酞无色,滴入氢氧化钠溶液随中和反应进行到最后一滴溶液从无色变为红色,且半分钟不褪色;
(2)依据图表数据分析可知,两次实验中消耗氢氧化钠溶液体积分别为:21.10ml-1.05ml=20.05ml、21.95ml-2.00ml=19.95ml,氢氧化钠溶液的平均体积为(20.05+19.95)/2ml=20.00ml,由酸碱中和反应可知,氢离子物质的量=氢氧化钠物质的量,则该待测液的浓度为C=0.1010mol·L-1×20mL/15mL≈0.1347mol·L-1。

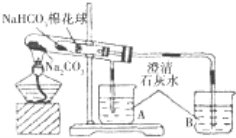
【题目】某小组同学通过对比实验了解Na2CO3和NaHCO3性质的异同,下表是他们撰写的实验报告的一部分。
① | 在贴有标签a、b的试管中分别加入1.0g Na2CO3固体和NaHCO3固体,观察外观。 | / |
② | 继续向两试管中分别加入10.0mL水,用力振荡,观察现象。 | / |
③ | 再分别向两试管中滴加2滴酚酞溶液,观察现象。 | 溶液均变红,颜色较深的试管是 (填 “a”或“b”)。 |
④ | 最后分别向两溶液中滴加足量盐酸。 | 红色褪去,均有无色气体产生.经计算生成气体的是a b(填“>”“<”或“=”)。 |
⑤ | 加热大试管一段时间。(注:棉花球沾有无水硫酸铜粉末)
| / |
(1)请帮助该小组同学完成实验报告中放入内容_____________。
(2)已知:20℃时Na2CO3的溶解度为20.5g。由实验_______(填实验序号)现象可知,20℃时NaHCO3的溶解度小于20.5g;如果向饱和Na2CO3溶液中不断通入CO2气体,现象是________,化学方程式是_________。
(3)由实验⑤可以得出结论是_______,用化学方程式说明得出结论的原因______。