题目内容
【题目】有如下反应(未配平):BrF3+H2O→Br2+O2+HBrO3+HF,反应后测得生成Br2与O2各1 mol。下列判断错误的是
A.反应共转移6 mol电子
B.氧化剂为BrF3,还原产物为Br2
C.配平后H2O与HF的物质的量之比为5∶9
D.被水还原的BrF3与被自身还原的BrF3的物质的量之比是1∶2
【答案】D
【解析】
反应BrF3+H2O→HBrO3+Br2+HF+O2↑中,溴元素的化合价由+3价变为+5价和0价,所以部分氟化溴失电子部分得电子,则氟化溴既是氧化剂又是还原剂,氧元素的化合价部分由-2价变为0价,所以部分水作还原剂,根据电子守恒,配平后的方程式如下:3BrF3+5H2O=HBrO3+Br2+O2+9HF,单线桥表示电子转移情况: ,以此来解答。
,以此来解答。
A. 由分析可知,单线桥表示该反应电子转移情况为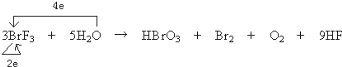 ,反应共转移2+4=6 mol电子,故A正确;
,反应共转移2+4=6 mol电子,故A正确;
B. 反应BrF3+H2O→HBrO3+Br2+HF+O2↑中,溴元素的化合价由+3价变为+5价和0价,氧化剂是BrF3,还原产物是Br2,故B正确;
C. 由分析可知配平后的方程式为:3BrF3+5H2O=HBrO3+Br2+O2+9HF,H2O与HF的物质的量之比为5∶9,故C正确;
D. 配平后的方程式:3BrF3+5H2O=HBrO3+Br2+O2+9HF,当有5.0mol水参加反应时,3molBrF3参与反应,反应共转移6 mol电子,水作还原剂,共有2mol水失去4mol电子,BrF3中作还原剂部分Br元素由+3价变为+5价,需要失去6mol-4mol=2mol电子,则作还原剂的BrF3的物质的量为1mol,作氧化剂的BrF3为2mol,被水还原的BrF3与被自身还原的BrF3的物质的量之比是2∶1,故D错误;
题目要求选错误的,故选D。

 备战中考寒假系列答案
备战中考寒假系列答案