题目内容
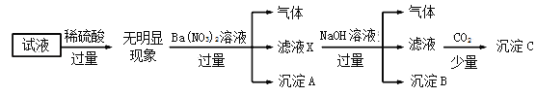
【题目】常温下,在体积均为20mL、浓度均为0.1mol·L-1的HX溶液、HY溶液中分别滴加同浓度的NaOH溶液,反应后溶液中水电离的c(H+)表示为pH水=-lgc(H+)水。pH水与滴加氢氧化钠溶液体积的关系如图所示。

下列推断正确的是
A.HX的电离方程式为HX=H++X-
B.T点时c(Na+)=c(Y-)>c(H+)=c(OH-)
C.常温下用蒸馏水分别稀释N、P点溶液,pH都降低
D.常温下,HY的电离常数![]()
【答案】D
【解析】
A. 依题意,HX和HY是两种一元酸。由图象知,加入氢氧化钠溶液,水电离程度增大,溶液由酸性逐渐变为中性,当恰好完全反应时溶液呈碱性且水电离程度达到最大值。HX为弱酸,故A错误。
B. T、P点对应的溶液都呈碱性,故B错误。
C. N点呈中性,加入蒸馏水稀释中性溶液,稀释后溶液仍然呈中性,故C错误。
D. 取M点计算电离常数,c(H+)=c(OH-)=1×10-7mol·L-1,混合溶液中![]() ,
,![]() ,
,![]() ,故D正确。
,故D正确。
故答案选D。

 阅读快车系列答案
阅读快车系列答案【题目】我国在南海北部神弧海域进行的可燃冰试采成功,这标志着我国成为全球第一个实现了在海域可燃冰试开采中获得连续稳定产气的国家。可燃冰主要成分是甲烷,可以用作燃料和制氢原料。甲烷自热重整是先进的制氢方法,包含甲烷氧化和蒸气重整两个过程。发生的主要反应如下:
化学方程式 | 焓变ΔH/(kJ·mol-1) | 活化能Ea/(kJ·mol-1) | |
甲烷氧化 | CH4(g)+2O2(g) | -802.6 | 125.6 |
CH4(g)+O2(g) | -322.0 | 172.5 | |
蒸气重整 | Ⅰ.CH4(g)+H2O(g) | +206.2 | 240.1 |
Ⅱ.CH4(g)+2H2O(g) | +165 | 243.9 |
下列说法不正确的是
A.CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=+41.2kJ·mol-1
CO2(g)+H2(g) ΔH=+41.2kJ·mol-1
B.反应Ⅱ逆反应活化能Ea=78.9kJ·mol-1
C.初始阶段:甲烷氧化的速率大于甲烷蒸气重整的速率
D.甲烷自热重整方法的突出优点是能量循环利用
【题目】中和热的测定是高中重要的定量实验。取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于如图所示的装置中进行中和热的测定实验,回答下列问题:

(1)从图中实验装置看,其中尚缺少的一种玻璃用品是___;
(2)为保证该实验成功该同学采取了许多措施,如图的碎纸条的作用在于___。
(3)若改用60mL0.25mol·L-1H2SO4和50mL0.55mol·L-1NaOH溶液进行反应与上述实验相比,所放出的热量___(填“相等”、“不相等”),若实验操作均正确,则所求中和热___(填“相等”、“不相等”)
(4)50mL0.55mol/LNaOH溶液和50mL0.25mol/L硫酸溶液的实验数据如下表:
请填写下表中的空白:
温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | ①___ |
2 | 27.0 | 27.4 | 27.2 | 32.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
4 | 26.4 | 26.2 | 26.3 | 29.8 | |
②近似认为50mL0.55mol/LNaOH溶液和50mL0.25mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g·℃)。则中和热ΔH=___J/mol(取小数点后一位)。
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是___(填字母)。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度