题目内容
【题目】CO2是目前大气中含量最高的一种温室气体,CO2的综合利用是解决温室问题的有效途径。
(1)研究表明CO2和H2在催化剂存在下可发生反应生成CH3OH。已知部分反应的热化学方程式如下:
CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(1)△H1=-726.5kJmol-1
O2(g)=CO2(g)+2H2O(1)△H1=-726.5kJmol-1
H2(g)+![]() O2(g)=H2O(1)△H2=-285.8kJmol-1
O2(g)=H2O(1)△H2=-285.8kJmol-1
H2O(g)=H2O(l) △H3=-44kJmol-1
则CO2与H2反应生成气态CH3OH和水蒸气的热化学方程式为__。
(2)为研究CO2与CO之间的转化,让一定量的CO2与足量碳在体积可变的密闭容器中反应:C(s)+CO2(g)![]() 2CO(g) △H,反应达平衡后,测得压强、温度对CO的体积分数(φ(CO)%)的影响如图所示。回答下列问题:
2CO(g) △H,反应达平衡后,测得压强、温度对CO的体积分数(φ(CO)%)的影响如图所示。回答下列问题:
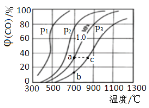
①压强p1__1.0MPa(填>、=或<)。
②900℃、1.0MPa时,足量碳与amolCO2反应达平衡后,CO2的转化率为__,该反应的平衡常数Kp=__(保留小数点后一位数字)(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)①以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸,CO2(g)+CH4(g)![]() CH3COOH(g)。为了提高该反应中CO2的转化率,可以采取的措施是___(写一条即可)。
CH3COOH(g)。为了提高该反应中CO2的转化率,可以采取的措施是___(写一条即可)。
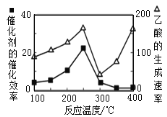
②在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。250~300℃时,乙酸的生成速率降低的主要原因是__;300~400℃时,乙酸的生成速率升高的主要原因是__。
(4)将1.0×10-3mol/LCoSO4与1.2×10-3mol/L的Na2CO3等体积混合,此时溶液中的Co2+的浓度为___mol/L。(已知:CoCO3的溶度积为:Ksp=1.0×10-13)
【答案】CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=-86.9kJmol-1 < 66.7% 3.2MPa 增大反应体系压强或增大CH4的浓度或将乙酸液化分离出来 催化剂的催化效率降低 温度升高,化学反应速率加快 1.0×10-9
CH3OH(g)+H2O(g) △H=-86.9kJmol-1 < 66.7% 3.2MPa 增大反应体系压强或增大CH4的浓度或将乙酸液化分离出来 催化剂的催化效率降低 温度升高,化学反应速率加快 1.0×10-9
【解析】
(1)根根据盖斯定律进行计算;
(2)同温下,可逆反应正方向为气体体积增大的反应,根据勒夏特列原理,压强小的一氧化碳体积分数大;
(3)根据有效碰撞理论和勒夏特列原理进行回答;
(4)根据溶度积公式进行计算。
(1)CO2与H2反应生成气态CH3OH和水蒸气的热化学方程式为CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H= -△H1+3△H2-△H3=-86.9kJmol-1。
CH3OH(g)+H2O(g) △H= -△H1+3△H2-△H3=-86.9kJmol-1。
(2)①同温下,p1压强下的一氧化碳体积分数大,可逆反应正方向为气体体积增大的反应,根据勒夏特列原理,压强p1<1.0MPa。
②由图可知,900℃、1.0MPa时,足量碳与amolCO2反应达平衡后,一氧化碳的体积分数为80%,设反应消耗了二氧化碳的物质的量为xmol,列三段式:
C(s)+CO2(g)![]() 2CO(g)
2CO(g)
反应前 amol 0
变化量 xmol 2xmol
反应后 (a-x)mol 2xmol
同温同压下,体积之比与物质的量之比相等,一氧化碳的体积分数=![]() ,即x=
,即x=![]() mol,CO2的转化率为
mol,CO2的转化率为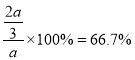 ,该反应的平衡常数Kp=
,该反应的平衡常数Kp=![]() ;
;
(3)①可逆反应为CO2(g)+CH4(g)![]() CH3COOH(g),根据有效碰撞原理,为了提高该反应中CO2的转化率,可以采取的措施是增大反应体系压强或增大CH4的浓度或将乙酸液化分离出来。
CH3COOH(g),根据有效碰撞原理,为了提高该反应中CO2的转化率,可以采取的措施是增大反应体系压强或增大CH4的浓度或将乙酸液化分离出来。
②在不同温度下催化剂的催化效率与乙酸的生成速率如图,250~300℃时,乙酸的生成速率降低的主要原因是催化剂的催化效率降低;300~400℃时,乙酸的生成速率升高的主要原因是温度升高,化学反应速率加快。
(4)CoCO3的溶度积Ksp=1.0×10-13=![]() ,将1.0×10-3mol/LCoSO4与1.2×10-3mol/L的Na2CO3等体积混合,碳酸根过量,此时碳酸根的浓度为
,将1.0×10-3mol/LCoSO4与1.2×10-3mol/L的Na2CO3等体积混合,碳酸根过量,此时碳酸根的浓度为![]() ,即此时溶液中的Co2+的浓度为
,即此时溶液中的Co2+的浓度为![]() 。
。

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案