题目内容
【题目】常温下,在25mL0.1mol/LNaOH 溶液中逐滴加入0.2mol/LCH3COOH 溶液,下图曲线所示的有关粒子浓度关系错误的是

A. 任一点一定都有c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
B. B点:a=12.5,c(Na+ ) =c(CH3COO-)>c(OH-)= c(H+)
C. C点:c(CH3COO-)+ c(CH3COOH)=2 c(Na+ )=0.1mol/L
D. C点:c(CH3COO-):c(CH3COOH))=3:2,则CH3COOH的Ka=1.5×10-5
【答案】B
【解析】A. 曲线上任一点都有c(Na+)+c(H+)=c(CH3COO-)+c(OH-)符合电荷守恒,故A正确;B、在B点溶液显中性,则结果是c(OH-)=c(H+),则a一定不等于12.5mL故B错误;C、在C点时,醋酸剩余,剩余的醋酸的浓度和生成的醋酸钠浓度相等均为0.05mol/l,根据物料守恒,则:c(CH3COO-)+c(CH3COOH)=0.1mol/L-1,故C正确;D. 因为 ![]() C点:c(CH3COO-):c(CH3COOH)=3:2 pH=5,c(H+)=10-5mol/L,所以CH3COOH的Ka=1.5×10-5,故D正确。
C点:c(CH3COO-):c(CH3COOH)=3:2 pH=5,c(H+)=10-5mol/L,所以CH3COOH的Ka=1.5×10-5,故D正确。

练习册系列答案
相关题目
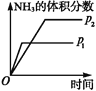
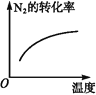
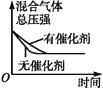
【题目】对于可逆反应N2(g)+3H2(g) ![]() 2NH3(g)ΔH<0,下列研究目的和示意图相符的是( )
2NH3(g)ΔH<0,下列研究目的和示意图相符的是( )
A | B | C | D | |
研究目的 | 压强对反应的影响(p2>p1) | 温度对反应的影响 | 平衡体系中增加N2浓度对反应的影响 | 催化剂对反应的影响 |
示意图 |
|
|
|
|
A. A B. B C. C D. D