题目内容
19.一定条件下的可逆反应:2SO2(g)+O2(g)?2SO3(g),若改变以下条件:①升高温度②增大反应物浓度③增大压强④使用催化剂,可提高反应物中的活化分子百分数的是①④.分析 提高反应物中的活化分子百分数因素有温度和催化剂,浓度和压强只改变活化分子的浓度,不改变百分数.
解答 解:①升高温度可提高反应物中的活化分子百分数,故①正确;
②增大反应物浓度只改变活化分子的浓度,不改变百分数,故②错误;
③增大压强只改变活化分子的浓度,不改变百分数,故③错误;
④加入催化剂,降低活化能,可提高反应物中的活化分子百分数,故④正确.
故答案为:①④.
点评 本题考查活化能的影响因素,题目难度不大,本题注意外界条件对反应速率的影响的根本原因.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.A、B、C三种强电解质,它们在水中电离出的离子如表所示:
如型l所示装置中,甲、乙、丙三个烧杯中依次盛放足量的A溶液、足量的B溶液、足量的c溶液,电极均为石墨电极.接通电源,经过一段时间后,测得乙中c电极质量增加了16g.常温下各烧杯中溶液的pH与电解时间t的关系如图2所示.请回答下列问题:
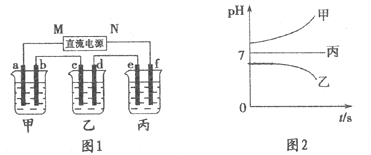
(1)M为直流电源的负极,b电极上发生的电极反应为4OH--4e-=2H2O+O2↑.
(2)计算e电极上生成的气体在标准状况下的体积为5.6L.
(3)写出乙烧杯中的总反应方程式:2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4.
(4)如果电解过程中B溶液中的金属离子全部析出,此时电解能否继续进行,为什么?能,因为CuSO4溶液已转变为H2SO4溶液,反应变为电解水.
(5)要使丙烧杯中的c溶液恢复到原来的状态,需要进行的操作是加入4.5gH2O.
| 阳离子 | Na+、K+、Cu2+ |
| 阴离子 | SO42-、OH- |

(1)M为直流电源的负极,b电极上发生的电极反应为4OH--4e-=2H2O+O2↑.
(2)计算e电极上生成的气体在标准状况下的体积为5.6L.
(3)写出乙烧杯中的总反应方程式:2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4.
(4)如果电解过程中B溶液中的金属离子全部析出,此时电解能否继续进行,为什么?能,因为CuSO4溶液已转变为H2SO4溶液,反应变为电解水.
(5)要使丙烧杯中的c溶液恢复到原来的状态,需要进行的操作是加入4.5gH2O.
7.下列有关元素性质递变情况的叙述中,正确的是( )
| A. | Li、Be、B原子最外层电子数依次减少 | |
| B. | P、S、Cl元素最高正价依次降低 | |
| C. | Na、K、Rb的金属性依次增强 | |
| D. | N、O、F原子半径依次增大 |
14.如图中表示外界条件(T、P)的变化对下列反应的影响L(s)+G(g)?2R(g);△H>0,y轴表示的是( )
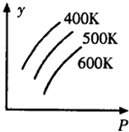

| A. | 平衡时,混合气体中R的百分含量 | B. | 平衡时,混合气中G的百分含量 | ||
| C. | G的转化率 | D. | L的转化率 |
4.下列关于元素性质的有关叙述中不正确的是( )
| A. | C、N、O、F的原子半径依次减小 | |
| B. | Na、K、Rb、Cs的失电子能力逐渐增强 | |
| C. | C、N、O、F的最高正价依次升高 | |
| D. | Na、Mg、Al、Si的最外层电子数依次增加 |
11.下列各项操作错误的是?( )
| A. | 为保证分液漏斗内的液体顺利流出,需将上面的塞子拿下 | |
| B. | 进行分液时,分液漏斗中的下层液体从下端流出,上层则从上口倒出 | |
| C. | 萃取、分液前需对分液漏斗时行检漏 | |
| D. | 用酒精萃取溴水中的碘单质的操作,可选用分液漏斗而后静置分液 |
8.可逆反应H2(g)+I2(g)?2HI(g)在密闭容器中反应,达到平衡状态时的标志是( )
| A. | 混合气体的密度不再改变 | |
| B. | 混合气体的颜色不再改变 | |
| C. | 混合气体的压强不再改变 | |
| D. | I2、H2在混合气体中的体积分数相等 |
9.常温下,pH=11的氨水和pH=1的盐酸等体积混合后(不考虑混合后溶液体积的变化),恰好完全反应,则下列说法不正确的是( )
| A. | 弱碱的浓度大于强酸的浓度 | |
| B. | 反应后的溶液呈酸性 | |
| C. | 原氨水中有1%的含氮微粒为NH4+ | |
| D. | 反应后的溶液中NH4+、NH3•H2O与NH3为0.05mol.L-1 |
 .Q的离子符号为OH-.
.Q的离子符号为OH-.