题目内容
14.如图中表示外界条件(T、P)的变化对下列反应的影响L(s)+G(g)?2R(g);△H>0,y轴表示的是( )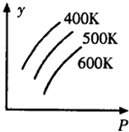
| A. | 平衡时,混合气体中R的百分含量 | B. | 平衡时,混合气中G的百分含量 | ||
| C. | G的转化率 | D. | L的转化率 |
分析 L(s)+G(g)?2R(g);△H>0,反应是气体体积增大的吸热反应,依据化学平衡移动原理结合图象分析判断,
温度升高,平衡正向进行,R的质量分数增大,压强增大平衡逆向进行,R的质量分数减小,L、G的质量分数增大,L的转化率减小,以此来判断.
解答 解:L(s)+G(g)?2R(g);△H>0,反应是气体体积增大的吸热反应,依据化学平衡移动原理结合图象分析判断,
A、温度升高,平衡正向进行,R的质量分数增大,压强增大平衡逆向进行,R的质量分数减小,图象不符合,故A错误;
B、温度升高,平衡正向进行,G的质量分数减小,压强增大平衡逆向进行,G的质量分数增大,符合图象变化,故B正确;
C、温度升高,平衡正向进行,G的量减小,G的转化率增大,压强增大,平衡逆向进行,G的量增大,G的转化率减小,图象不符合,故C错误;
D、温度升高,平衡正向进行,L的量减小,L的转化率增大,压强增大平衡逆向进行,L的量增大,L的转化率减小,故D错误.
故选B.
点评 本题考查了化学平衡的移动原理的分析判断,掌握反应的特征和平衡移动原理是解题关键,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
10.设NA代表阿伏伽德罗常数,下列叙述正确的是( )
| A. | 将1molNH4NO3溶于一定浓度的稀氨水中,溶液呈中性,若不考虑挥发,溶液中含有的NH4+数目小于NA | |
| B. | 24g石墨烯(单层石墨)中含有六元环的个数为NA | |
| C. | 标准状况下,6.72LNO2与足量水反应转移电子数目为0.2NA | |
| D. | 4.6gC2H6O加入足量的金属钠,充分作用,生成H2分子数一定为0.05NA |
5.下列叙述正确的是( )
| A. | 同主族元素从上到下,元素原子得电子能力逐渐减弱,表现在氢化物的稳定性逐渐增强 | |
| B. | 除稀有气体元素外,第三周期元素的原子半径不一定比第二周期元素的原子半径大 | |
| C. | 化学反应的过程中一定伴随着热量的变化 | |
| D. | 在主族元素中,最外层电子数少的元素原于一定比最外层电子数多的元素原子失电子能力强 |
2.下列各组物质中,不是按 (“→”表示一步完成)关系相互转化的是( )
(“→”表示一步完成)关系相互转化的是( )
 (“→”表示一步完成)关系相互转化的是( )
(“→”表示一步完成)关系相互转化的是( )| 选项 | A | B | C | D |
| a | Fe | H2SO4 | Al(OH)3 | HNO3 |
| b | FeCl3 | SO2 | Na[Al(OH)4] | NO |
| c | FeCl2 | SO3 | Al2O3 | NO2 |
| A. | A | B. | B | C. | C | D. | D |
6.某有机物在O2中充分燃烧生成CO2和H2O的物质的量之比为1:2,由此可得出的结论是( )
| A. | 该有机物分子中C、H、O原子个数比为1:4:1 | |
| B. | 该有机物分子中C、H原子个数比为1:4 | |
| C. | 该有机物中必定含有氧元素 | |
| D. | 该有机物化学式为CH4O |
3.北京奥运会期间,志愿者使用的快餐盒内层是用铝箔包裹并已加工好的真空包装食品,外层则是分别包装的两包化学物质,吃饭前拉动预留在外的拉线使这两种化学物质接触反应,放出的热量便可对食物进行加热,最适合做这两包化学物质的是( )
| A. | 浓硫酸和水 | B. | 熟石灰和水 | C. | 生石灰和水 | D. | 氯化钠和水 |
4.一定质量的下列有机物在氧气中完全燃烧,生成二氧化碳质量与碳原子数无关的是( )
| A. | 环烷烃 | B. | 醇类 | C. | 炔烃 | D. | 油脂 |
 如图表示的是在800℃时,含有A、B、C三种气体的体系中各物质浓度随时间变化的情况,请回答:
如图表示的是在800℃时,含有A、B、C三种气体的体系中各物质浓度随时间变化的情况,请回答: