题目内容
【题目】(1)已知浓度均为0.1 mol/L的8种溶液:①CH3COONa、②KCl、③NH4Cl 、④NaOH 、⑤Ba(OH)2、⑥HNO3、⑦H2SO4、⑧CH3COOH,其溶液的pH由小到大的顺序是__________________________(填写序号)。
(2)25℃时,若体积为Va、pH=a的某一元强酸溶液与体积为Vb、pH=b的某一元强碱溶液混合,恰好中和。请回答:
若a+b=12,则Va: Vb=________。
若Va<Vb和a=0.5b,则a的取值范围是_________________。
【答案】 ⑦⑥⑧③②①④⑤ 1:100 ![]() <a<
<a<![]()
【解析】(1)属于碱的为:⑤Ba(OH)2④NaOH,物质的量浓度相同时,pH:⑤>④;水解呈碱性的为:①CH3COONa,但水解程度较小,则pH:⑤>④>①;溶液呈中性的为:②KCl;溶液呈酸性的有:③⑥⑦⑧,其中⑥为一元强酸,⑦为二元强酸,⑧为弱酸,③水解呈酸性,物质的量浓度相同时,溶液的pH:⑦<⑥<⑧<③,综合以上分析可知,溶液的pH由小到大的顺序是为:⑦⑥⑧③②①④⑤,故答案为:⑦⑥⑧③②①④⑤;
(2) ![]() =
=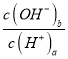 =
=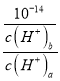 =
=![]() =10(a+b14),若a+b=12,
=10(a+b14),若a+b=12, ![]() =10(a+b14)=10-2=
=10(a+b14)=10-2=![]() ;若Va<Vb,则
;若Va<Vb,则![]() =10(a+b14) <1,所以(a+b-14)<0,而a=0.5b,即3a<14,a<
=10(a+b14) <1,所以(a+b-14)<0,而a=0.5b,即3a<14,a<![]() ,又pH=b=2a>7,a>
,又pH=b=2a>7,a>![]() ,所以
,所以![]() <a<
<a<![]() ,故答案为:
,故答案为: ![]() ;
; ![]() <a<
<a<![]() 。
。

【题目】甲乙两同学对保存已久的Na2SO3试剂进行试验探究。取适量Na2SO3样品于洁净烧杯中,加入适量蒸馏水,充分搅拌全部溶解。
(1)测上述溶液的PH值,其PH值>7,原因是(用离子方程式表示)_____________________________________
(2)取少量上述溶液于试管中,加入硝酸钡溶液生成白色沉淀,再加入盐酸,白色沉淀不溶解,甲认为已变质,乙认为他的结论不科学,理由是________________________________
(3)假设试剂由Na2SO3和Na2SO4组成,设计试验方案,进行成分检验,他们决定继续探究,请写出实验步骤、预期现象和结论。
限选试剂及仪器:稀盐酸、稀硝酸、氯化钡溶液,品红溶液,酸性高锰酸钾溶液,NaOH溶液、澄清石灰水、pH计、烧杯、试管、带塞导气管、滴管
实验步骤 | 预期现象和结论 |
步骤1:取适量试剂于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置。 | |
步骤2:取适量步骤1所得溶液于试管中 加入少量的____________________溶液。 | 若溶液褪色,说明其有_________若溶液不褪色,说明其中没有______ |
步骤3: 再取适量步骤1所得溶液于另一试管中,先加入足量的稀盐酸,再滴 加___________溶液。 | 如果有白色沉淀生成,则说明其中有_____________,已经变质。 如果没有白色沉淀生成,则说明其中 没有_____________ |
(4)经实验检验后,确实已变质,现准确测定其中Na2SO3的含量。实验如下:
①配制250ml 约0.2molL-1 Na2SO3溶液:准确称取w克试样,置于烧杯中,加适量蒸馏水溶解,将溶液转入____________,洗涤,定容,摇匀。
②滴定:准确量取25.00ml Na2SO3所配制溶液于锥形瓶中,将 0.05molL-1酸性高锰酸钾装入50ml__________(填酸式或碱式)滴定管,滴定至终点,记录数据。重复滴定2次。平均消耗KMnO4VmL。
③计算Na2SO3的质量分数=______________(只列出计算式,不要求算出结果)