题目内容
13.在体积为2L的密闭容器中发生反应3A(g)+B(g)=2C(g),若最初加入的A和B都是4mol,A的平均反应速率为0.12mol•L-1•s-1,则反应进行10s后容器中B的物质的量是( )| A. | 2.8 mol | B. | 1.6 mol | C. | 0.4 mol | D. | 3.2 mol |
分析 利用速率之比等于其化学计量数之比v(B),再根据△c(B)=v(B)•△t计算B的浓度变化量△c(B),根据n=cV计算△n(B),进而计算10s时B的物质的量.
解答 解:A的平均反应速率为0.12mol•L-1•s-1,则v(B)=$\frac{1}{3}$×0.12mol•L-1•s-1=0.04mol•L-1•s-1,
故△c(B)=0.04mol•L-1•s-1×10s=0.4 mol/L,
10s后容器中B的物质的量=4mol-0.4mol•L-1×2L=3.2 mol,
故选D.
点评 本题考查化学反应速率的有关计算,比较基础,注意公式的理解与灵活运用.

练习册系列答案
 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目
3.下列反应中氯元素仅被还原的是( )
| A. | 5Cl2+I2+6H2O═10HCl+2HIO3 | |
| B. | 2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O | |
| C. | MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑ | |
| D. | HCl+NaOH═NaCl+H2O |
4.常温下可以盛放浓硫酸的容器是( )
| A. | 塑料 | B. | Fe | C. | Al | D. | Mg |
1.下列物质混合时能发生反应,但无明显现象的是( )
| A. | 二氧化碳与苯酚钠溶液 | B. | 乙酸钠溶液与盐酸溶液 | ||
| C. | 苯酚溶液与氯化铁溶液 | D. | 氢氧化铜悬浊液与乙酸溶液 |
8.活泼金属氢化物是火箭燃料的重要供氢剂,如氢化钠、氢化钙等.例如,氢化钙的供氢原理是CaH2+2H2O=Ca(OH)2+2H2下列有关分析中正确的是( )
| A. | 氢化钙中含共价键,水中含非极性键 | |
| B. | 水分子和氢分子中都存在氢氢非极性共价键 | |
| C. | 氢氧化钙只存在离子键 | |
| D. | 该反应断裂离子键和共价键,生成离子键和共价键 |
18.下列关于化学反应限度的说法中正确的是( )
| A. | 一个可逆反应达到的平衡状态就是这个反应在该条件下所能达到的限度 | |
| B. | 当一个可逆反应达到平衡状态时,正反应速率和逆反应速率相等,都等于0 | |
| C. | 平衡状态是一种静止的状态,因为反应物和生成物的浓度已经不再改变 | |
| D. | 化学反应的限度不可以通过改变条件而改变 |
5.下列说法中,不正确的是( )
| A. | 氯气可用于消毒和制造漂白粉 | B. | 氨气可用于制造氮肥 | ||
| C. | 乙烯可用于制造塑料 | D. | 铝制容器可用于盛放稀硫酸 |
 某种融雪剂,其主要成分的化学式为XY2,图为X原子的结构示意图,X的阳离子与Y的阴离子的电子层结构相同.元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子.
某种融雪剂,其主要成分的化学式为XY2,图为X原子的结构示意图,X的阳离子与Y的阴离子的电子层结构相同.元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子.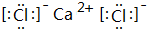 .
.