��Ŀ����
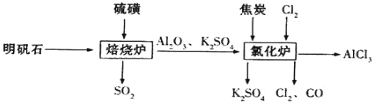
����Ŀ����ˮ�Ȼ�����һ����Ҫ�Ļ���ԭ�ϣ���ҵ����������ʯ�Ʊ���ˮ�Ȼ������������£���ش��������⣺
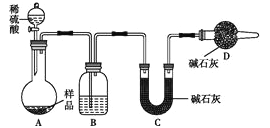
��1�� ʵ������,���Ƶ�Cl2�������____________�����������
��MnO2��Ũ�����Ϲ��� ��MnO2��NaCl��Ũ�����Ϲ���
��NaClO�������Ϲ��� ��Ư�ۺ������������
��2�� ���ձ���¯�в�����β��������װ����������___________�����������
��3��д������¯����Ӧ�Ļ�ѧ����ʽ_____________��
��4�������������Ĺ���������¯������¯�в�����SO2��Cl2�ȴ�����Ⱦ����������������һ������ͨ��ˮ�пɼ�����Ⱦ������Ƽ�ʵ���������Ƿ�ǡ����ȫ��Ӧ����Ҫ����ʵ�鲽�衢����ͽ���_____________��������ѡ����
�ɹ�ѡ���Լ����£�
���μӷ�̪������������Һ �ښ⻯������Һ �����軯����Һ ��Ʒ����Һ
��5��ijͬѧ���������װ����֤���������ijЩ��ѧ���ʡ�

�� ��˵������������������Ե�ʵ������Ϊ____________��
�� д��aƿ�з�����Ӧ�����ӷ���ʽ________________��
�� ��ַ�Ӧ��ȡaƿ�е���Һ�ֳ����ݣ��ֱ��������ʵ����
ʵ��I:���һ����Һ�м���������NaOH��Һ�����ɰ�ɫ������Ѹ�ٱ�Ϊ����ɫ�����ձ�Ϊ���ɫ��
ʵ��II:��ڶ�����Һ�м�������KMnO4��Һ����ɫ��ȥ��
ʵ��III:���������Һ�м���BaCl2��Һ�����ɰ�ɫ������
����ʵ�����ܳ��֤������������л�ԭ�Ե���__________����ʵ���������
���𰸡���1���٢ڢۢ�
��2��ad
��3��Al2O3+3C+3Cl2![]() 2AlCl3+3CO
2AlCl3+3CO
��4��ȡ������Һ���������Թ��У��μ�Ʒ����Һ����Ʒ����Һ����ɫ��˵������ǡ����ȫ��Ӧ���������δ��ȫ��Ӧ��
��5����b�г��ֵ���ɫ������2Fe3++SO2+2H2O=SO42-+2Fe2++4H+�ۢ���II
��������
�����������1�� MnO2��Ũ�����Ϲ������������� NaCl��Ũ�����Ϲ��������Ȼ��⣬����MnO2��NaCl��Ũ�����Ϲ�����������������NaClO�������Ϲ����������з�Ӧ������������Ư�ۺ���������������������з�Ӧ���������������ձ���¯�в�����β���Ƕ�����������װ����Ҫ��������bװ�õķ�����װ�ð�ȫƿ�ĵ��ܴ���c������װ������3������ͼʾ������¯����Ӧ�Ļ�ѧ����ʽAl2O3+3C+3Cl2![]() 2AlCl3+3CO���� SO2��Cl2����һ������ͨ��ˮ��������������ᣬ�ɼ�����Ⱦ��SO2��Cl2����ʹƷ����ɫ����������Ƿ�ǡ����ȫ��Ӧ������ȡ������Һ���������Թ��У��μ�Ʒ����Һ����Ʒ����Һ����ɫ��˵������ǡ����ȫ��Ӧ���������δ��ȫ��Ӧ����5���� �������������Ʒ�Ӧ��������������ֶ�������������ԣ���˵������������������Ե�ʵ������Ϊb�г��ֵ���ɫ�������� aƿ�з�����Ӧ�����ӷ���ʽ2Fe3++ SO2+2H2O = SO42-+2Fe2++4H+�������һ����Һ�м���������NaOH��Һ�����ɰ�ɫ������Ѹ�ٱ�Ϊ����ɫ�����ձ�Ϊ���ɫ��˵����һ����Һ�������������ӣ���֤������������л�ԭ����KMnO4��Һ��ɫ��˵���л�ԭ�����ʣ�ԭ��Һ������������ӣ�����BaCl2��Һ���ɰ�ɫ����������֤������������л�ԭ����
2AlCl3+3CO���� SO2��Cl2����һ������ͨ��ˮ��������������ᣬ�ɼ�����Ⱦ��SO2��Cl2����ʹƷ����ɫ����������Ƿ�ǡ����ȫ��Ӧ������ȡ������Һ���������Թ��У��μ�Ʒ����Һ����Ʒ����Һ����ɫ��˵������ǡ����ȫ��Ӧ���������δ��ȫ��Ӧ����5���� �������������Ʒ�Ӧ��������������ֶ�������������ԣ���˵������������������Ե�ʵ������Ϊb�г��ֵ���ɫ�������� aƿ�з�����Ӧ�����ӷ���ʽ2Fe3++ SO2+2H2O = SO42-+2Fe2++4H+�������һ����Һ�м���������NaOH��Һ�����ɰ�ɫ������Ѹ�ٱ�Ϊ����ɫ�����ձ�Ϊ���ɫ��˵����һ����Һ�������������ӣ���֤������������л�ԭ����KMnO4��Һ��ɫ��˵���л�ԭ�����ʣ�ԭ��Һ������������ӣ�����BaCl2��Һ���ɰ�ɫ����������֤������������л�ԭ����

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ��
��Ʒ�� | GB5461 |
��Ʒ�ȼ� | һ�� |
�� �� | ʳ�Ρ�����ء������ |
�⺬������I�ƣ� | 20��50mg/kg |
��1���������⻯�������������·������·�Ӧ����ƽ��ѧ����ʽ������ѧ���������ڿհ״���
KIO3+ KI+ H2SO4= K2SO4+ I2+ H2O
��2��������Ӧ���ɵ�I2�������Ȼ�̼���顣�������Ȼ�̼��Һ�м���Na2SO3ϡ��Һ����I2��ԭ���Ի������Ȼ�̼��
��Na2SO3ϡ��Һ��I2��Ӧ�����ӷ���ʽ�� ��
��ijѧ����ƻ������Ȼ�̼�IJ���Ϊ��
a����������Ȼ�̼��Һ���ڷ�Һ©���У�
b����������Na2SO3ϡ��Һ��
c��������²�Һ�壻
d������Һ©���������
���з�Һ©��ʹ��ǰ����еIJ����� ������������ȷ��˳���� (����ţ�
��3����֪��I2+2S2O32���T2I��+S4O62����ijѧ���ⶨʳ�þ����εĵ⺬�����䲽��Ϊ��
a��ȷ��ȡwgʳ�Σ�����������ˮʹ����ȫ�ܽ⣻
b����ϡ�����ữ������Һ����������KI��Һ��ʹKIO3��KI��Ӧ��ȫ��
c���Ե���Ϊָʾ������μ������ʵ���Ũ��Ϊ2.0��10��3mol�� L��1��Na2S2O3��Һ10.0mL��ǡ�÷�Ӧ��ȫ��
���ж�c�з�Ӧǡ����ȫ���ݵ������� ��
��b�з�Ӧ��������I2�����ʵ����� mol��
����������ʵ��Ͱ�װ��˵�������⾫���εĵ⺬���ǣ��Ժ�w�Ĵ���ʽ��ʾ�� mg/kg��