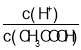题目内容
【题目】下列装置图或曲线图与对应的叙述相符的是
A.如下图所示,用 0.1 mol·L-1 NaOH 溶液分别滴定相同物质的量浓度、相同体积的盐酸和醋酸,其中实线表示的是滴定盐酸的曲线
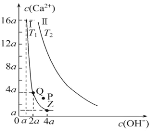
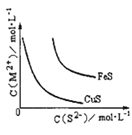
B.某温度下 FeS、CuS 的沉淀溶解平衡曲线如下图 所示。在物质的量浓度相等的 Fe2+和 Cu2+的溶液中滴加硫化钠溶液,首先沉淀的离子为 Fe2+
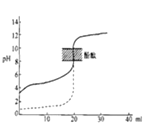
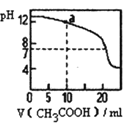
C.如下图 所示,用 0.1 mol·L-1CH3COOH 溶液滴定 20 mL 0.1 mol·L-1 NaOH 溶液的滴定曲线, 当 pH=7 时:c(Na+) = c(CH3COO-) > c(OH-) = c(H+)
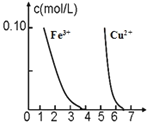
D.据下图,若除去CuSO4 溶液中的 Fe3+可向溶液中加入适量CuO 至 pH 在 5.8 左右
【答案】C
【解析】
A.醋酸存在电离平衡,同浓度同体积盐酸和醋酸,开始时盐酸溶液pH小于醋酸,所以虚线表示的是滴定盐酸的曲线,故A错误;
B.依据图象分析可知,硫化铜溶度积小于硫化亚铁,同浓度Fe2+和Cu2+的溶液中滴加硫化钠溶液,先析出的沉淀是硫化铜,故B错误;
C.反应后溶液pH=7,依据溶液中电荷守恒分析,用0.1mol·L-1CH3COOH溶液滴定20mL 0.1mol·L-1NaOH溶液,反应生成醋酸钠,溶液呈中性,溶液中存在电荷守恒,c(H+)+c(Na+)=c(OH-)+c(CH3COO-),c(H+)=c(OH-),则c(CH3COO-)=c(Na+),得到当pH=7时:c(Na+)=c(CH3COO-)>c(OH-)=c(H+),故C正确;
D.分析图象可知铁离子完全沉淀的pH为3.7,加入氧化铜会调节溶液pH,到pH=5.5时铜离子会沉淀,应调节溶液pH小于5.5,故D错误;
故选C。

【题目】已知:pAg=-lgc(Ag+),pX=-lg c(Xn-)。298K时,几种物质的Ksp如下表:
化学式 | AgCl | AgSCN | Ag2CrO4 |
颜色 | 白 | 浅黄 | 红 |
Ksp | 1.8×1010 | 1.0×1012 | 2.0×1012 |
AgCl、AgSCN、Ag2CrO4的饱和溶液中,阳离子和阴离子的浓度关系如图所示。下列说法正确的是
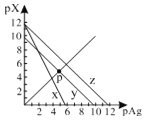
A.图中x代表AgCl曲线,z代表AgSCN曲线
B.298K时,在Cl-和CrO42-的物质的量浓度均为0.1mol/L的溶液中,滴入少量0.1mol/L的AgNO3溶液,首先产生的是红色沉淀
C.298K时若增大p点的阴离子浓度,则y上的点沿曲线向上移动
D.298K时Ag2CrO4(s)+2SCN-(aq) ![]() 2AgSCN(s)+CrO42- (aq)的平衡常数K=2.0×1012
2AgSCN(s)+CrO42- (aq)的平衡常数K=2.0×1012