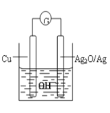
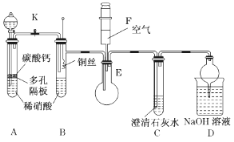
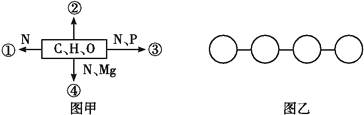题目内容
【题目】室温下将0.1mol·L-1的烧碱溶液不断滴加到10.00mL相同浓度的HA溶液中,溶液中-lgc水(H+)与NaOH溶液的体积关系如图所示[注:c水(H+)为溶液中水电离的c(H+)]。下列说法不正确的是( )
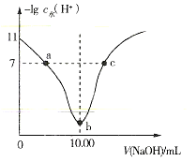
A.a、c两点溶液中均存在:c(H+)+c(Na+)=c(OH-)+c(A-)
B.b点溶液中存在:c(H+)+c(HA)=c(OH-)
C.a、b、c三点溶液中,b点溶液导电性最强
D.0.1mol·L-1HA溶液中HA的电离度约为1%
【答案】C
【解析】
由图可知,HA为弱酸,b点溶液中水电离的c(H+)最大,说明氢氧化钠和HA恰好完全反应生成NaA,a点为HA和NaA的混合液,c点为NaA和NaOH的混合液。
A. a点为HA和NaA的混合液,c点为NaA和NaOH的混合液,溶液中均存在电荷守恒关系c(H+)+c(Na+)=c(OH-)+c(A-),故A正确;
B. b点为NaA溶液,溶液中存在质子守恒关系c(H+)+c(HA)=c(OH-),故B正确;
C. a点为HA和NaA的混合液,b点为NaA溶液,c点为NaA和NaOH的混合液,c点中离子浓度最大,溶液导电性最强,故C错误;
D.由图可知0.1mol·L-1的HA溶液中水电离的c(H+)为10—11mol·L-1,溶液中的c(H+)为![]() mol·L-1=10—3mol·L-1,HA的电离度约为
mol·L-1=10—3mol·L-1,HA的电离度约为![]() ×100%≈1%,故D正确;
×100%≈1%,故D正确;
故选C。

练习册系列答案
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
相关题目