题目内容
【题目】周期表中前四周期的元素A、B、C、D,原子序数依次增大,且A、B、C同周期。A共有两个原子轨道上有电子,且电子数目相同。B、C相邻,且C中的未成对电子数为3个,D是人类最早使用的元素,并以这种元素命名了一个时代。请回答下面的问题:
(1)A、B、C第一电离能从小到大的顺序为:__________________(填元素符号),D的价层电子排布图为:_______________________。
(2)在不同的温度下,A以ACl2和二聚体 A2Cl4两种形式存在,二聚体的结构式如下图所示:
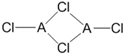
①ACl2中A的杂化方式为_____________。
②1mol A2Cl4中含配位键的数目为_____________。
(3)B元素能形成多种同素异形体,其中一种同素异形体X的晶体结构和晶胞结构如图所示。已知X的密度是a g/cm3,B-B键的键长为r cm,阿伏加德罗常数的值为NA。
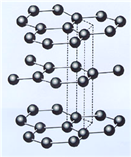
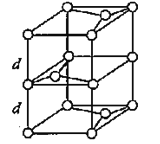
X的晶体结构(左)和晶胞(右)
①X中含有的化学键为____________________。
②X晶体的层间距离为___________________。
(4)C元素可以形成两种含氧酸HCO2和HCO3,酸性是HCO3___HCO2(填“强于”或者“弱于”),原因为__________________________。
(5)将二维密置层在三维空间内堆积,可以得到两种金属晶体的最密堆积方式。一种是按照XYXYXYXY……方式堆积,我们称这种堆积方式为“甲”方式。另外一种是按照XYZXYZXYZXYZ……方式堆积,我们称这种堆积方式为“乙”方式。则金属D的堆积方式为_______。(填“甲”或“乙”)
【答案】 Be<C<N ![]() sp
sp ![]() 共价键 金属键
共价键 金属键 ![]() cm 强于 HNO3中含有更多的非羟基氧,C的正电性越高,导致N-O-H中的电子向N偏移,因而在水分子的作用下就越容易电离出H+,即酸性越强。 乙
cm 强于 HNO3中含有更多的非羟基氧,C的正电性越高,导致N-O-H中的电子向N偏移,因而在水分子的作用下就越容易电离出H+,即酸性越强。 乙
【解析】周期表中前四周期的元素A、B、C、D,原子序数依次增大。A共有两个原子轨道上有电子,且电子数目相同,则A的电子排布式为1s22s2,所以A为4号铍元素。且A、B、C同周期,B、C相邻,且C中的未成对电子数为3个所以C为7号N元素,则B是6号C元素。人类最早使用的金属是铜,D是人类最早使用的元素,所以D是29号元素Cu。
(1)A、B、C第一电离能从小到大的顺序为:Be<C<N,D的价层电子排布图为:![]() 。
。
(2)①BeCl2中心原子Be形成2个σ键且没有孤电子对,价层电子对数为2对,所以Be的杂化方式为sp杂化。
②1个氯化铍二聚体分子中有2个配位键,所以1mol Be2Cl4中含配位键的数目为![]() 。
。
(3)①由X的晶体及晶胞结构特点可知,X为石墨。石墨是混合晶体,碳原子采用sp2杂化与周围3个碳原子形成共价键,每个碳原子还有一个电子在2p轨道上,同一片层所有碳原子的未参与形成σ键的2p轨道相互平行并形成了大π键,这些2p轨道中的电子可以在整个层内自由运动,所以石墨具有导电性,因此石墨中含有的化学键为共价键、金属键。
②每个晶胞中占有的C原子数=![]() ,则NA个该晶胞的质量为48g.该晶胞是四棱柱,底面是连长为
,则NA个该晶胞的质量为48g.该晶胞是四棱柱,底面是连长为![]() r cm 的菱形,高为2d,所以该晶胞的体积为V:V=
r cm 的菱形,高为2d,所以该晶胞的体积为V:V=![]() ,
,
NA个该晶胞的体积为![]() ,由上面两个数据可以表示出晶胞的密度为
,由上面两个数据可以表示出晶胞的密度为
![]() =
=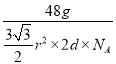 =a g/cm3,解之得d=
=a g/cm3,解之得d=![]() (单位是cm),即X晶体的层间距离为
(单位是cm),即X晶体的层间距离为![]() cm。
cm。
(4)N元素可以形成两种含氧酸HNO2和HNO3,酸性是HNO3强于HNO2,
原因为HNO3中含有更多的非羟基氧,N的正电性越高,导致N-O-H中的电子向N偏移,因而在水分子的作用下就越容易电离出H+,即酸性越强。
(5)将二维密置层在三维空间内堆积,可以得到两种金属晶体的最密堆积方式。一种是按照XYXYXYXY……方式堆积,我们称这种堆积方式为“甲”方式。甲方式的晶胞是六方最密堆积。另外一种是按照XYZXYZXYZXYZ……方式堆积,我们称这种堆积方式为“乙”方式。乙方式的晶胞是面心最密堆积。因为金属铜的晶胞是面心立方,所以金属Cu的堆积方式为乙。

 科学实验活动册系列答案
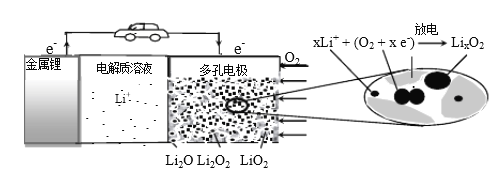
科学实验活动册系列答案【题目】新能源汽车的大力推广,带动锂电池材料的发展。我国科学家研发出利用钛铁矿(主要成分为![]() ,还含有少量
,还含有少量![]() 、
、![]() 、
、![]() 等杂质)制备锂离子电极材料—
等杂质)制备锂离子电极材料—![]() 和
和![]() 的工艺流程如下:
的工艺流程如下:
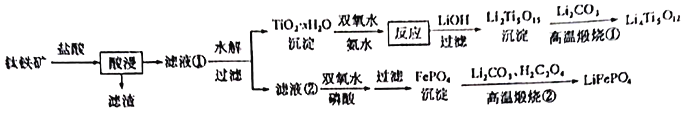
回答下列问题:
(1)![]() 中,Fe元素的化合价为____________。
中,Fe元素的化合价为____________。
(2)“酸浸”后,钛主要以![]() 形式存在,写出
形式存在,写出![]() 水解的的离子方程式_________________。
水解的的离子方程式_________________。
(3)![]() 沉淀与双氧水、氨水反应40min所得实验结果如下表所示:
沉淀与双氧水、氨水反应40min所得实验结果如下表所示:
温度/℃ | 30 | 35 | 40 | 45 | 50 |
| 92 | 95 | 97 | 93 | 88 |
分析高于40℃时![]() 转化率下降的原因_______________。
转化率下降的原因_______________。
(4)![]() 中Ti的化合价为
中Ti的化合价为![]() ,其中过氧键的数目为_____________。
,其中过氧键的数目为_____________。
(5)滤液②中加入双氧水和磷酸,反应生成![]() 的离子方程式为____________;若测得Fe3+沉淀完全后,溶液中
的离子方程式为____________;若测得Fe3+沉淀完全后,溶液中![]() 为
为![]() ,则常温下溶液的pH=______________。(已知
,则常温下溶液的pH=______________。(已知![]() 的
的![]() )
)
(6)从滤液②中得到![]() 沉淀之后,要对其进行洗涤、干燥,检验沉淀已经洗涤干净的方法_________________________________________。
沉淀之后,要对其进行洗涤、干燥,检验沉淀已经洗涤干净的方法_________________________________________。