题目内容
【题目】新能源汽车的大力推广,带动锂电池材料的发展。我国科学家研发出利用钛铁矿(主要成分为![]() ,还含有少量
,还含有少量![]() 、
、![]() 、
、![]() 等杂质)制备锂离子电极材料—
等杂质)制备锂离子电极材料—![]() 和
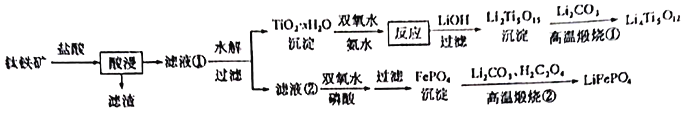
和![]() 的工艺流程如下:
的工艺流程如下:
回答下列问题:
(1)![]() 中,Fe元素的化合价为____________。
中,Fe元素的化合价为____________。
(2)“酸浸”后,钛主要以![]() 形式存在,写出
形式存在,写出![]() 水解的的离子方程式_________________。
水解的的离子方程式_________________。
(3)![]() 沉淀与双氧水、氨水反应40min所得实验结果如下表所示:
沉淀与双氧水、氨水反应40min所得实验结果如下表所示:
温度/℃ | 30 | 35 | 40 | 45 | 50 |
| 92 | 95 | 97 | 93 | 88 |
分析高于40℃时![]() 转化率下降的原因_______________。
转化率下降的原因_______________。
(4)![]() 中Ti的化合价为
中Ti的化合价为![]() ,其中过氧键的数目为_____________。
,其中过氧键的数目为_____________。
(5)滤液②中加入双氧水和磷酸,反应生成![]() 的离子方程式为____________;若测得Fe3+沉淀完全后,溶液中
的离子方程式为____________;若测得Fe3+沉淀完全后,溶液中![]() 为
为![]() ,则常温下溶液的pH=______________。(已知
,则常温下溶液的pH=______________。(已知![]() 的
的![]() )
)
(6)从滤液②中得到![]() 沉淀之后,要对其进行洗涤、干燥,检验沉淀已经洗涤干净的方法_________________________________________。
沉淀之后,要对其进行洗涤、干燥,检验沉淀已经洗涤干净的方法_________________________________________。
【答案】![]()
![]() 温度过高过氧化氢分解、氦水易挥发 4
温度过高过氧化氢分解、氦水易挥发 4 ![]() 3 取最后一次洗涤液少许于试管中,加入硝酸酸化的硝酸银溶液,若无白色沉淀产生,说明已经洗涤干净
3 取最后一次洗涤液少许于试管中,加入硝酸酸化的硝酸银溶液,若无白色沉淀产生,说明已经洗涤干净
【解析】
钛铁矿主要成分为![]() ,还含有少量
,还含有少量![]() 、
、![]() 、
、![]() 等杂质,加盐酸后
等杂质,加盐酸后![]() 不溶解,被过滤掉,钛主要以
不溶解,被过滤掉,钛主要以![]() 形式存在,
形式存在,![]() 、
、![]() 变成Mg2+、Ca2+,Fe2+得滤液①,水解得滤液②中含有Fe2+ 、Mg2+、Ca2+和大量的Cl-,在酸性条件下,Fe2+被双氧水氧化,得到
变成Mg2+、Ca2+,Fe2+得滤液①,水解得滤液②中含有Fe2+ 、Mg2+、Ca2+和大量的Cl-,在酸性条件下,Fe2+被双氧水氧化,得到![]() 。以此进行解答。
。以此进行解答。
(1)根据化学式中元素化合价代数和为零计算![]() 中,Fe元素的化合价为+2价,答案:+2;
中,Fe元素的化合价为+2价,答案:+2;
(2)“酸浸”后,钛主要以![]() 形式存在,
形式存在, ![]() 能发生水解,的的离子方程式
能发生水解,的的离子方程式![]() 。答案:
。答案:![]() ;
;
(3)低于40°C,![]() 转化反应转化率随温度升高而增加;超过40C双氧水分解与氨气逸出导致
转化反应转化率随温度升高而增加;超过40C双氧水分解与氨气逸出导致![]() 转化反应转化率下降;答案:温度过高过氧化氢分解、氨水易挥发。
转化反应转化率下降;答案:温度过高过氧化氢分解、氨水易挥发。
(4)![]() 中Ti的化合价为
中Ti的化合价为![]() ,Li为+1价,所以正化合价总和为22价,设表现-1价的氧原子为x个,表现-2价的氧原子为y个,根据化学式中元素化合价代数和为零x+2y=22;x+y=15,解得x=8,y=7,所以过氧键的数目为4,答案:4。
,Li为+1价,所以正化合价总和为22价,设表现-1价的氧原子为x个,表现-2价的氧原子为y个,根据化学式中元素化合价代数和为零x+2y=22;x+y=15,解得x=8,y=7,所以过氧键的数目为4,答案:4。
(5)滤液②中含有Fe2+,在酸性条件下,被双氧水氧化成Fe3+,和磷酸根结合成![]() 沉淀,其反应的离子方程式为
沉淀,其反应的离子方程式为![]() ;若测得Fe3+沉淀完全后,溶液中
;若测得Fe3+沉淀完全后,溶液中![]() 为
为![]() ,根据沉淀溶解平衡原理可知:c3(OH-)=
,根据沉淀溶解平衡原理可知:c3(OH-)=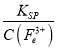 =
=![]() =10-33,c(OH-)=10-11 mol/L,c(H+)=10-3mol/L, 则常温下溶液的pH=3;答案:
=10-33,c(OH-)=10-11 mol/L,c(H+)=10-3mol/L, 则常温下溶液的pH=3;答案:![]() ;3;
;3;
(6)因为滤液②中含有大量的Cl-,遇到硝酸酸化的硝酸银溶液会有白色沉淀产生,所以得到![]() 沉淀之后,要对其进行洗涤、干燥,检验沉淀已经洗涤干净的方法:取最后一次洗涤液少许于试管中,加入硝酸酸化的硝酸银溶液,若无白色沉淀产生,说明已经洗涤干净。答案:取最后一次洗涤液少许于试管中,加入硝酸酸化的硝酸银溶液,若无白色沉淀产生,说明已经洗涤干净。
沉淀之后,要对其进行洗涤、干燥,检验沉淀已经洗涤干净的方法:取最后一次洗涤液少许于试管中,加入硝酸酸化的硝酸银溶液,若无白色沉淀产生,说明已经洗涤干净。答案:取最后一次洗涤液少许于试管中,加入硝酸酸化的硝酸银溶液,若无白色沉淀产生,说明已经洗涤干净。

 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案